
1.4卤化物多卤化物卤素互化物 1.卤化物: 卤素与电负性比较小的元素生成的化合物。 2.卤化物的分类: 金属卤化物: 离子型:CsF,NaCL,BaCl,LaCl3 共价型AgC(I8e构型) A1C13,SnCl4,FeCl3,TiCl4(高氧化值金属) 非金属卤化物:BE3,SF4,PCl5,SP,等
1.4 卤化物 多卤化物 卤素互化物 2.卤化物的分类: 金属卤化物: 2 LaCl3 离子型:CsF,NaCl,BaCl , 非金属卤化物: 3 4 5 SF6 BF ,SiF ,PCl , 等 卤素与电负性比较小的元素生成的化合物。 1.卤化物: - AlCl ,SnCl ,FeCl ,TiCl ( ) AgCl(18e ) 3 4 3 4 高氧化值金属 构型 共价型

3.卤化物的性质: 性质: 离子型 共价型 熔点: 高 低 溶解性: 大多易溶于水 易溶于有机溶剂 导电性:水溶液,熔融导电 无导电性 金属卤化物 非金属卤化物 水解性:对应氢氧化物不 易水解 是强碱的都易水 产物为两种酸 解,产物为氢氧 BXSiXiPCI 化物或碱式盐 Sn(OHCL,SbOCl,BiOCI P280
水解性: 性质: 离子型 共价型 熔点: 高 低 溶解性: 大多易溶于水 易溶于有机溶剂 导电性:水溶液,熔融导电 无导电性 对应氢氧化物不 是强碱的都易水 解,产物为氢氧 化物或碱式盐 易水解, 产物为两种酸 BX3 ,SiX4 ,PCl3 金属卤化物 非金属卤化物 3.卤化物的性质: Sn(OH)Cl,SbOCl,BiOCl P280
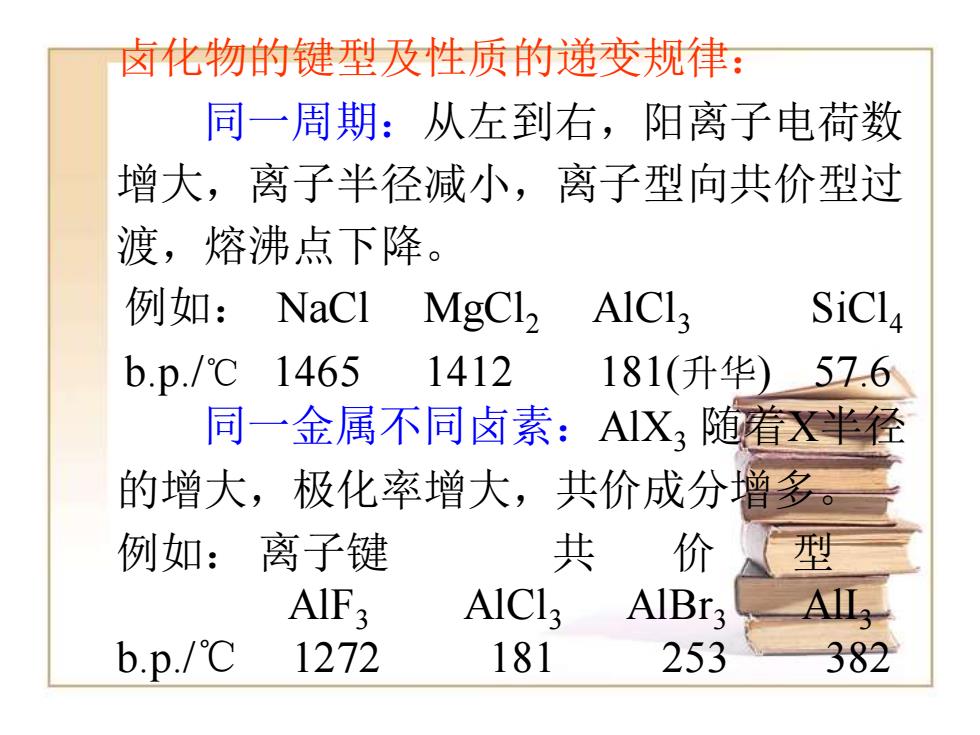
卤化物的键型及性质的递变规律: 同一周期:从左到右,阳离子电荷数 增大,离子半径减小,离子型向共价型过 渡,熔沸点下降。 例如:NaCl MgCl, A1C13 SiCl4 b.p./℃1465 1412 181(升华) 57.6 同一金属不同卤素:AX,随着X半经 的增大,极化率增大, 共价成分增多。 例如:离子键 共 价 型 AIF3 A1C13 AlBr3 b.p./℃ 1272 181 253 382
卤化物的键型及性质的递变规律: 同一周期:从左到右,阳离子电荷数 增大,离子半径减小,离子型向共价型过 渡,熔沸点下降。 例如: NaCl MgCl2 AlCl3 SiCl4 b.p./℃ 1465 1412 181(升华) 57.6 同一金属不同卤素:AlX3 随着X半径 的增大,极化率增大,共价成分增多。 例如: 离子键 共 价 型 AlF3 AlCl3 AlBr3 AlI3 b.p./℃ 1272 181 253 382
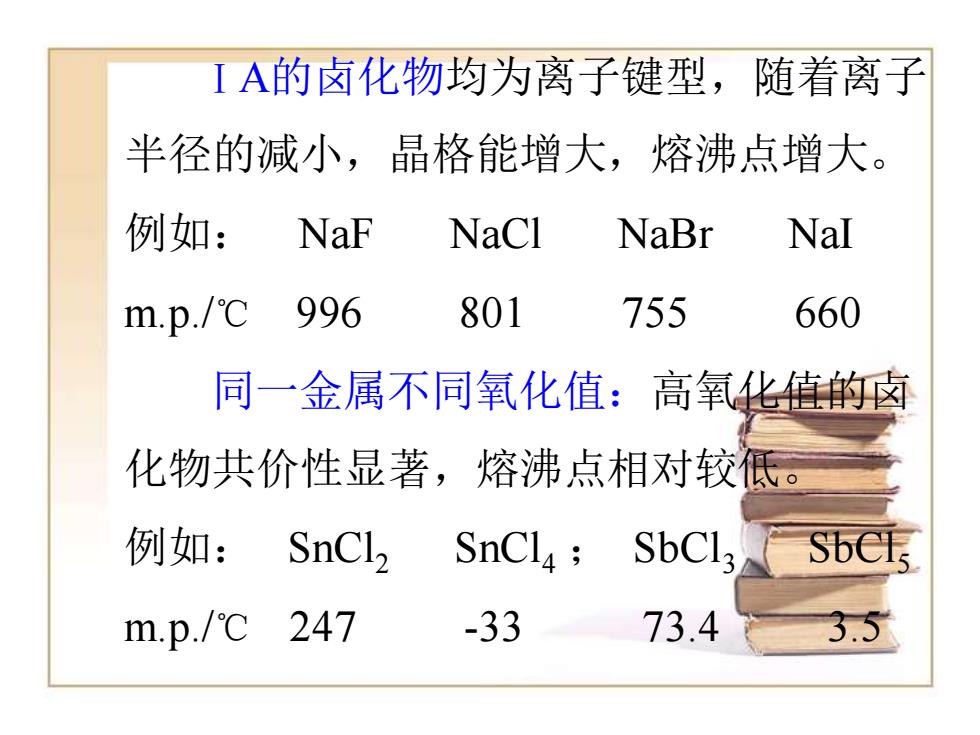
IA的卤化物均为离子键型,随着离子 半径的减小,晶格能增大,熔沸点增大。 例如:NaF NaCl NaBr NaI m.p./℃ 996 801 755 660 同一金属不同氧化值:高氧化值的卤 化物共价性显著,熔沸点相对较低。 例如:SnCl2 SnCla;SbCla Sbels m.p./℃247 -33 73.4 3.5
ⅠA的卤化物均为离子键型,随着离子 半径的减小,晶格能增大,熔沸点增大。 例如: NaF NaCl NaBr NaI m.p./℃ 996 801 755 660 同一金属不同氧化值:高氧化值的卤 化物共价性显著,熔沸点相对较低。 例如: SnCl2 SnCl4 ; SbCl3 SbCl5 m.p./℃ 247 -33 73.4 3.5
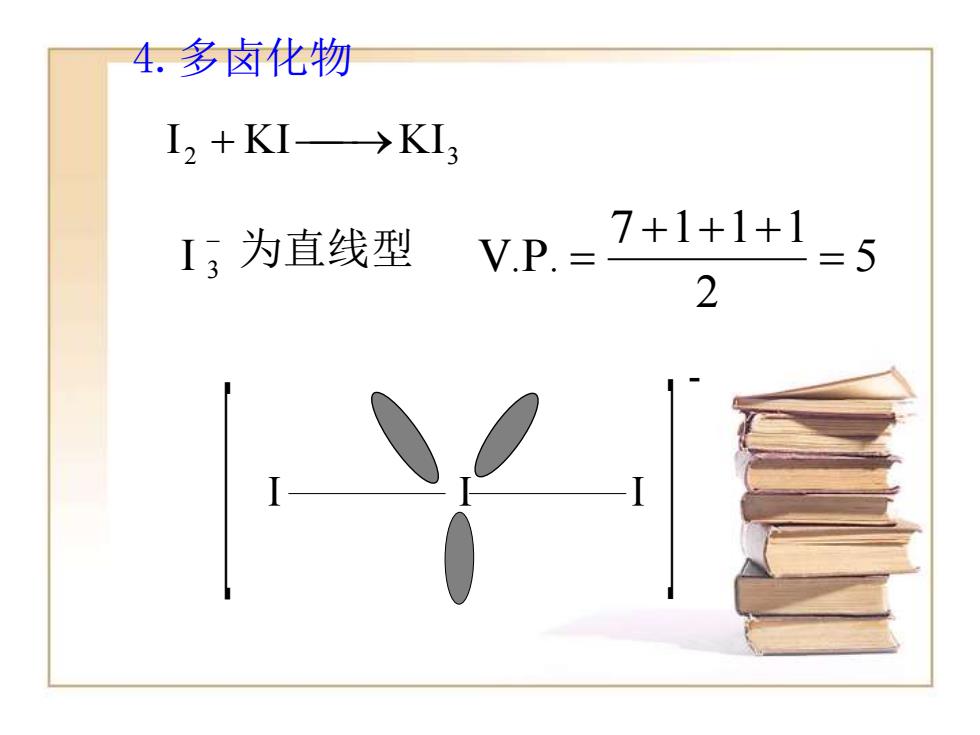
4.多卤化物 I2+KI→KI3 I;为直线型 VP.= 7+1+1+1 2
2 KI KI3 I + ⎯→ - 3 I 为直线型 5 2 7 1 1 1 V.P. = + + + = I I I - 4.多卤化物