
《生物化学》教案 授课题目 学时安排 第六章 蛋白质表征 4学时 掌握蛋白质的两性解离 教 相对分子质量测定方法 蛋白质含量测定原理 ◇ 熟悉胶体性质 的 沉淀方法 和 分离纯化的般原则 各种分离纯化方法:纯度鉴定 求 了解蛋白质的分子大小 沉淀方法:相对分子质量测定方法 教学重点 蛋白质含量测定原理 分离纯化的般原则 相对分子质量测定方法 教学难点 分离纯化方法 纯度鉴定 教学过程 讲授结合多媒体课件 作业 P317习题1、5、6、7、8

教学内容 导言 蛋白质的理化性质和氨基酸相似,有两性解离及等电点、紫外吸收和呈色反应。作为生 物大分子,还有胶体性质、沉淀、变性和凝固等特点。要了解和分析蛋白质结构和功能的关 系就要利用其特殊的理化性质,采取盐析、透析、电泳、层析及离心等不损伤蛋白质空间构 象的物理方法分离纯化蛋白质。这些方法的原理是什么?如何提取、纯化,鉴定、测定蛋白 质?且听一一分解 第六章蛋白质的分离、纯化和表征 第一节表征 蛋白质的化性质利氨基酸似,有两性解离及等电点、紫外吸收和星色反应。作为生 物大分子还有胶体性质、沉淀,变性和旋固等特点。要了解和分析蛋白质结构和功能的关 系戒要利用其特殊的理化性质,采取款析、透析、电泳、层析长离心等不损伤黄白质空间剜构 象的物理方法分离纯化蛋白质。 一、蛋白质的酸碱性(掌握) 两性、pl 概念同氨基酸 各解离基团的解离情况 AH--→A-+H+ B+H--→B+H pH<pK左式 pH=pK各半 pH>pK右式 AH一COOH、一SH,-一酚H BH一N+H,一咪唑+H,一圆+H 白质和氨基酸一样是两性电解质,在溶液中的荷电状态受川值影刚。当茧白质溶液 处于老 山时,黄白质解成不、负子的趋势 即成 兼性离子,净电荷为零 时溶液的p称为该蛋白质的等电点。p1>pl时,该蛋白质粒带负电荷,反之则带正电荷 在人体体液中多数蛋白质的等电点接近H5,所以在生理H7.4环境下,多数黄白质解离 成阴离子。少量蛋白质,鱼精蛋白、组蛋白的偏于碱性,称碱性蛋白质,而胃蛋白南 和丝蛋白为酸性蛋白。 二、蛋白质的相对分子质量测定方法(重点、难点) (一)、据组成测最低相对分子质量 知某组分的含量,求蛋白质的相对分子质量? :某组分量/蛋白质相对分子质量-该组分百分含量(x%)∴. 某组分的原子或分子量 蛋白质相对分子质量 =某组分量/×100 X% 又:某组分有时不知它在分子中有几个,“所得是其最低相对分子质量,真实值

为其倍数」 例1 肌红蛋白和血红蛋白念供量均为0.335% 带入上式得相对分子质量=55.8÷0.335%=16757 但肌红蛋白含1个铁 血红蛋白含4个铁 所以,肌红蛋白为16700:血红蛋白为4×16700 即血红蛋白相对分子质量=4×55.8÷0.335% 例2 某蛋白含亮氨酸1.65%,异亮2.48%,求其相对分子质量? 民点得 131/1.65%=7939注:理论上应以残基计131-18,实际可以分子计) 据异亮得 131/2.48%=5282 先通过二者摩尔百分含量比求出二者个数比: 1.65/131 2.48/131=1/1.5=23 计算时约分(以小数为1),不要除 据亮得 2×13111.65%=15879 3×131/2.48%-15847 该蛋白最低相对分子质量为 15900/15800 :2、3不是亮、异的个数,15800是最低相对分子质量, 若此题分为两个题,则其最低相对分子质量分别是7900、5200(分别以一个计) 此法比较准确,但有时雅得真实量,如例2 (二)、渗透压法 渗透压与溶质颗粒数(摩尔数)有关,即 r=nRT/V=g/M·RT/V=g/V·RTM=cRT/M 渗透压可测得 气体常数 T 恤对混度 溶液体积 溶质摩尔质量即相对分子质量 g/V -c 溶液浓度,自己配制的,已知 从中解出M即可 此法简单易测,也较准确,但对样品的纯度要求较高。 (三)、扩散法 即扩散系数法 由于扩散系数不只与相对分子质量有关,还较大程度取决于其分子形状,所以,一般 不单独使用。路 (四)、沉降分析法 1、沉降速度法 最准确可靠的方法(Svedberg于1940年设计): 蛋白质题粒在2550×10g离心力作用下从溶液中沉降下来。 沉降系数(s)片单位(cm)离心场甲的沉降速度。 s=v/02X "-沉降速度(da =离心机转子角速度(弧度/s) =转速(每分钟旋转次数)×2刀/60 x二蛋白质界面中点与转子中心的距离(©m》 沉降系(常)数的单位:秒

蛋白质分子量()与沉降系(s)的关系 M=RTs/D (I-Ve) 斯维得贝格(Svedberg)方程 —气体常数(8.314×101ergs·mo1-1·度-1) 下—绝对温度 )—扩散常数(蛋白质分子量很大,离心机转速很快,则忽路不计) 单位浓度梯度时,1秒内通过1cm界面所扩傲的溶质的量 —蛋白质的微分比容(3·g1,水溶液为0.74加入溶质使溶剂的增 p—溶剂密度(20℃,g·m1-1) 一沉降系数 通过上式求得 北法为是可靠的方法 生物大 子的沉降系数介于(1~200)×10-1秒 定义10一13为 个S(斯维得贝格单位或沉降系数单位 15.8 SrRNA、70S核糖体(30S+50S) 2、沉降平衡法 指沉降与扩散的平衡 M2 RT)o2(2-2 蛋白质波面距轴心距离 x1处蛋白浓度 2处蛋白浓度 此法理论完善,但对高心机性能要求较高 (五)、凝胶过滤法 溶质透过凝胶的速度只与分子形状(斯托克半径)有关 斯托完半径:某种蛋白质与理想的非水化球具有相同的过杜速度,即 相同的洗脱体积,则认为二者半径相同。其半径称为蛋白质的斯托克半径 示意图 小分子进入凝胶粒内,路长,慢 凝胶粒内有大分子丝之间同漆 大分子穿过凝胶粒问,路短,快 洗脱体积 某颗粒最大量流出时的洗脱液毫升数 浓平 1020304050 ◆洗脱体积(第mL) 相对分子质量与洗脱体积关系式 (经验式,1966年Andrews提出) lgMr=ab·/b·eo b 为常数 为外水体积 为洗脱体积 比法是用与特动美形状辉推经台质的装电汉来生的。 ·实测时,常用标准曲线来求得
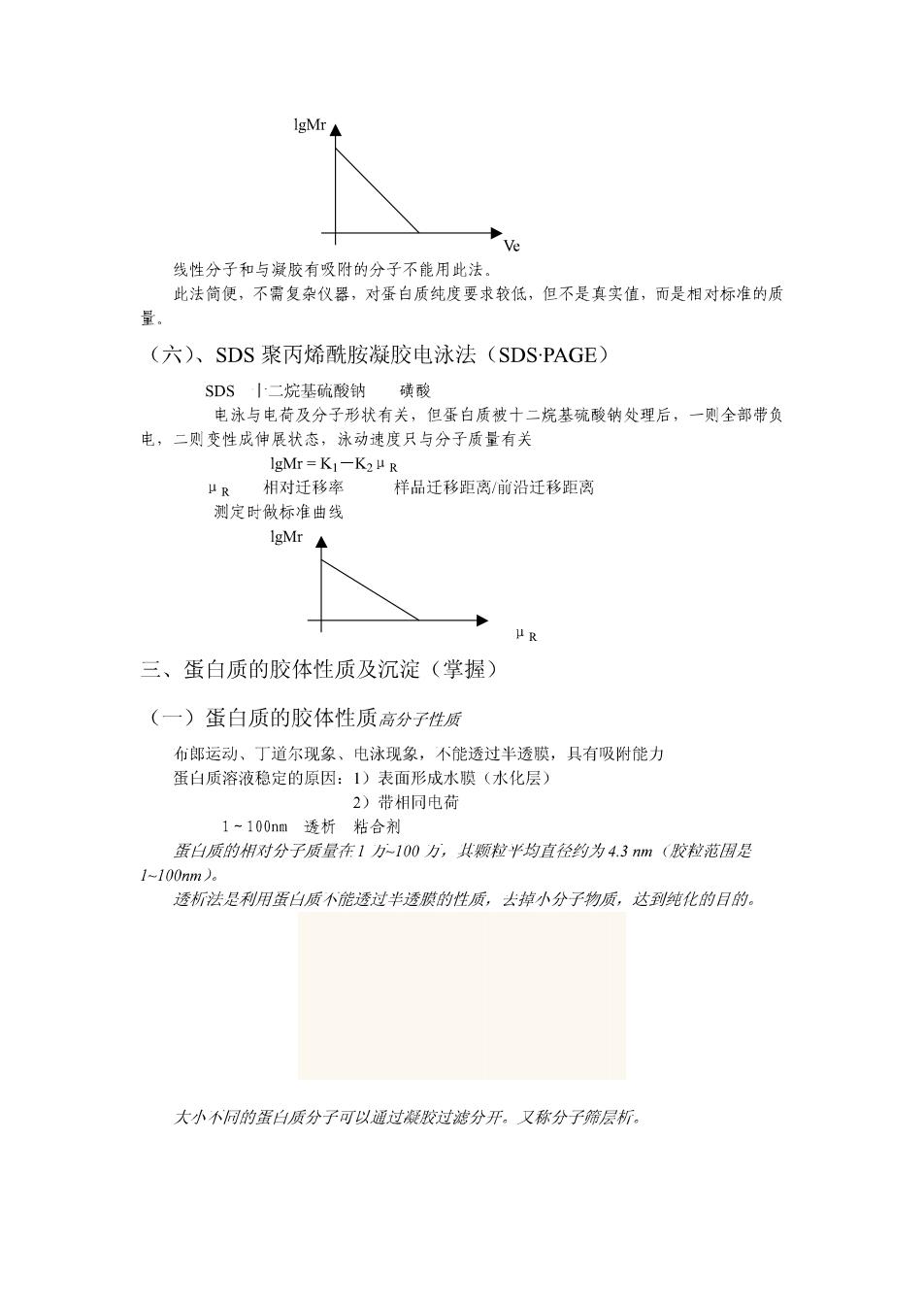
lgM 线性分子和与凝胶有吸附的分子不能用此法. 此法简便,不需复杂仪器,对蛋白质纯度要求较低,但不是真实值,而是相对标准的质 (六)、SDS聚丙烯酰胶胺凝胶电泳法(SDS-PAGE) SDS丨二烷基硫酸钠磷酸 电泳与电荷及分子形状有关,但蛋白质被十二烷基统酸钠处理后,一则全部带负 电,二则变性成伸展状态,泳动速度只与分子质量有关 1gMr=K一K2μR H R 相对迁移率 样品迁移距离/前沿迁移距离 测定时做标准曲线 IgMr μR 三、蛋白质的胶体性质及沉淀(掌握) (一)蛋白质的胶体性质高分子性质 布郎运动、丁道尔现象、电泳现象,不能透过半透膜,具有吸附能力 蛋白质溶液稳定的原因:1)表面形成水膜(水化层) 2)带相同电荷 1-100nm添析、牡合剂 蛋白质的用对分子质量在1万10万,其颍粒半均直径约为43m(歌粒范用足 1-100nm) 透析法是利用蛋白质不能透过半透膜的性质,去掉小分子物质,达到纯化的目的。 大小小同的蛋白质分子可以通过胶过滤分开。又称分子筛层析