
《生物化学》教案 授课题目 学时安排 第八章 酶机制及维生素 4学时 教 掌握活性部位特点:别构调控:酶原激活:共价修饰, 学 维生素的概念:分类:生理功能 各种维生素的结构特征、活性形式、功能 的 熟悉底物和酶的邻近效应:底物形变和诱导契合:酸碱 和 催化:共价催化:金属离子催化:多元催化与协同效应 好 维生素缺乏原因 求 了解维生素的来源、性质 酶活性部位特点 教学 别构调控:共价修饰 重点 维生素概念:分类:功能 别构调控 教学 共价修饰 难点 维生素的结构特征 教学过程 讲授结合多媒体课件 P430习题之1、3 作业 P468习题之1、6、8、9、10

教学内容 导言 通过上一章的学习,你已经知道酶是什么,他的特点、分类、命名、标号、影响活力的 六种因素及其影响你也了然于胸,什么?你还有疑问?不知道酶是如何工作的?不知道酶的 话性是如何变化的?不知道铺陈与维生素有何关系?不急,咱们一起看看科学家是怎祥说 的 第八章酶的作用机制及维生素 第一节酶的活性部位 有关概念 必需基团: 对酶活性只有不可替代作用的氨基酸成基及辅助因子。 这些基团若经化学修饰使其改变,则南的活性丧失。 结合基团专一性 活性部位 活性中心必需基团 必需基团 催化基团 催化性质 结构基 维持酶的空间结 为维持活性中心的的象所 称为游活性中心以外的必需基团 常见必需基团:组、赖、天、谷、丝、半、酪、精及辅因子 与酶活性直接相关的区域,叫酶的活性中心/部位 酶分子中与底物结合并使之变化的区城,一 活性中心必需基团在痘分子中的分布区城,一 它是山布线性多链中可能隔很远的氨基酸线基形成的二维小区(为 缝或为凹陷)。活性部位的基团属必需基包 有二种, 一是结合团,其作用是与底物 合,生成藤底物复合物:二是催化基团,其作用是影啊底物分子中某些化学键的意定性, 催化底物发生化学反应并促进底物转变成产物,也有的必需基团同时有这两种功能。 构成腰活性中心的常见基团有组氨酸的咪唑基,丝氨酸的羟基,半就氨酸的疏基等 丝氨酸簧白感家族的败蛋白德、贴旋乳蛋白德和弹性蛋白感,部饿化白质的使之水 解,但底物的专 性山它们的底 结合部位中氨基酸基团的性质所决定 与其作用的底物 五补。像陵蛋白游,在它的底物结合部丝有带负电荷的Ap线基,可与底物侧链上带正尾 荷的L灯和4g相五作用,切断其要基侧:映旋乳蛋白蘑在它的底物结合部位有带小侧链 的氨基酸线基,G孙和S,使底物庞大的芳香的和硫水氯基酸线基得以进入,切所其按 甚:弹样蛋白游有组对大的d和T加不普内荷的复甚酸國能,乃出在的底物结合部 位,阻止了除和G小腐链以外的所有其他氨酸。 活性中心必需基团在空问结构上一定靠近? 活性中心必需基团在一级结构上一定靠近? 一、活性部位特点(重点) -般是几个残加辅热
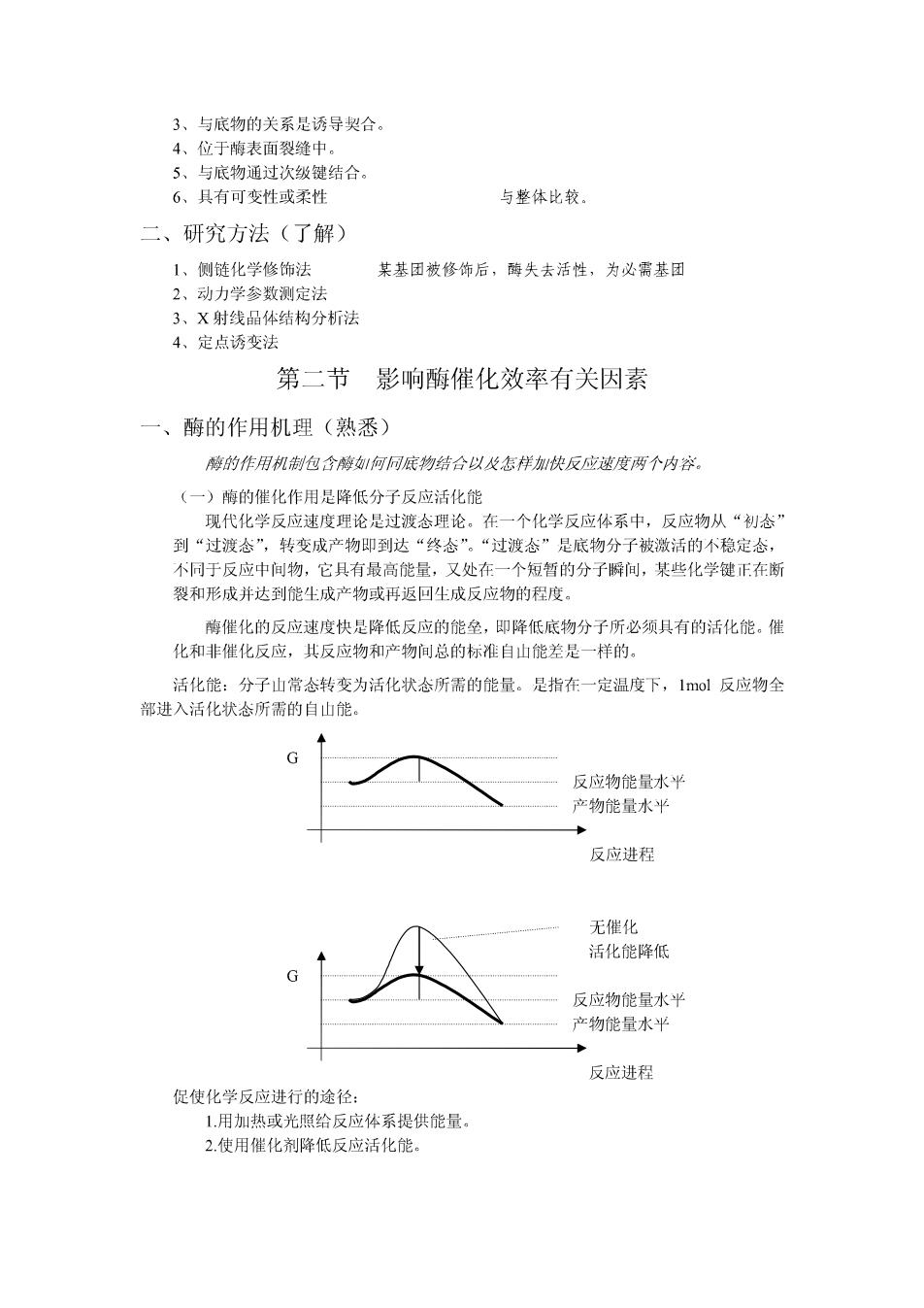
3、与底物的关系是诱导契合。 4、位于地表面裂缝中, 5、与底物通过次级键结合 6,具有可变性或柔性 与整体比较。 二、研究方法(了解) 1、侧链化学修饰法 某基团被修饰后,酶失去活性,为必需基团 2,动力学参数定别 3、X射线品体结构分析法 4、定点诱变法 第二节影响酶催化效率有关因素 一、 酶的作用机理(熟悉) 的作用机制包何同底物结合以收怎样快反应速度两个内容 (一)酶的催化作用是降低分子反应活化能 现代化学反应速度理论是过渡念理论。在一个化学反应体系中,反应物从“初念 到“过渡态”,转变成产物即到达“终态”。“过渡态”是底物分子被激活的不稳定态, 不同于反应中间物,它具有最高能量,又处在一个短暂的分子瞬间,某些化学键正在断 裂和形成并达到能生成产物或再返回生成反应物的程度。 牌催化的反应速度快是降低反应的能垒,即降低底物分子所必须具有的活化能。催 化和非催化反应,其反应物和产物间总的标准自山能差是 样的 活化能:分子山常态转变为活化状态所需的能量。是指在一定温度下,1mol反应物全 部进入活化状念所需的自山能。 反成物能量水华 产物能量水 反应进程 无催化 活化能降低 反应物能量水平 产物能量水平 反应进程 促使化学反应进行的途径: 1用加热或光照给反应体系提供能量。 2.使用催化剂降低反应活化能

酶和一般催化剂的作用就足降低化学反应所需的活化能,从而使活化分子数增多,反应 速度加快。 (二)中间产物学说 通过与底物结合而降低其反应活化能 E+S ES E+P 中间产物存在的证据: 1.同位素32p标记底物法(磷酸化酶与葡萄糖结合): 2.吸收光谱法(过氧化物与过氧化氢结合) 不意图 20世纪初和40年代,科学家就提出了修底物复合物的形成和过授态概念,即E+S →ES→E+P.廖和底物形成中间产物的学说已为实验所证实,月分离到若干种ES 结品。 (二)诱导嵌合学说: 锁钥学说”(Fischer,1890 南的活性中心结构与底物的结构互相吻合,紧帝结合成中间络合物。 诱导嵌合学说(Koshland,1958) 悔活性中心的结构有一定的灵活性,且与底物相近吻合,当底物(或其相 似物产物、竞争性抑制剂等)与酶分子靠近时,诱导蛋白的构象发生了有利于与底物结 合的变化,使反应所需的催化基团和结合基团正确地排列和定向,转入有效的作用位咒,这 样使裤与底物完全吻合,结合成中产物。 锁的学说示意图 诱导契合学说示意图 二、影响酶催化效率的因素(熟悉》 游促反应高礼率的原因常常是多种催化机制的综合应用,除做底物结合的诱导梨合假 说外,还有: 1,邻近定向效应:酶与底物结合成中间产物过程中,底物分子从稀溶液中密集到活性 中心区,并使活性中心的催化基团与底物的反应基团之间正确定向排列所产生的效应 底物聚集于活性中心,使有效浓度增加,增加 分子碰撞机会 定向底物的反应基团之何及与催化基团之问的正疏取位 在两个以上底物参与的反应中,山于榜的作用,底物被聚集到脑分子表面,破此用五靠 近并形成正确的定向关系,大大提高了底的的局部度,底被催化的部位定向他对推孽的 活性中心,实际上是将分子向的反应变成类似于分子内的反应,从而大大是高催化效率。 ”与“形变 :酵与底物的结合,不仪酶分子发生构象变化,同样底物分子也会 发生扭曲变形,使底物分子的某些键的键能减弱,产尘键扭曲,降低了反应活化能, 底物敏感健的电子云受催化基团的亲或排影响,失去平衡,产生张力,发生性变

3.酸碱催化:通过向反应物(作为碱)提供质子或从反应物(作为酸)夺取质子米达 到加速反应的一类催化。(广义酸碱催化,Bronsted的酸碱定义) 通过高浓度的H或0州的催化叫狭义酸碱催化,如强酸强碳催化水解反应 通过高浓度的H或O州和A或A的催化叫广义酸碱催化。AH质子供体,质子受 蛋白质中起酸或碱催化的功能基团有氨基、羧基、咪唑基、统基和酚基。 影响酸成催化反应速度的两种因素:(1)酸或成的强度(K):(2)质子传递的速 度。 Hs的咪唑基最活跃。因为其pK=6,接近体液p值,一半供体,一半受体,酸 皆宜。 4.共价催化:底物分子的一部分与?分子上的活性基团间通过共价结合而形成的中间 物,快速完成反应。 s的酸碱由子理论:酸是可以接受由子对的物质,而成则是可以提供由子对的物质 前者是亲电物质,后者是亲核物质 共价催化又称亲核或亲电子催化实际上也是酸碱催化 采核物质 Ser-OH CH2O:→电 Cys-SH 一CH2—S:+物 His-咪唑堪 N 酶分子中常见的亲核基田有:羟基、蔬基、咪唑基、氨基等 底物分子常见的亲电多 团有 磷基、酰 、糖基等 鸥分子中常见的亲电基田有:质子、镁、锰、铁、锌等离子 底物分子常见的亲核基团有:二氧化碳等 例如ATP水解 0”亲核 H亲电 ADP-P-OI来电 0-酶氧亲核 对底物/电击,得A叩-Pm-过态 0 再解成AD和磷酸,磷酸酶和水发生上述类似反应,得磷酸和酶 在此类过程中,酶分子发生了共价变化 常见反应类型为基团转移和水解反应 反应机制为乒乓反应 5.金属离子催化 作为辅因子(过渡元素)或激活剂(碱或碱土金属)。过渡铁、同、锌、锰等 城及碱土钠、钾、钙、镁等 催化方式:结合底物为反应定向:受给电子参与氧化还原反应 屏蔽底物负电荷:亲电催化 6、微环境的影 牌的活动中心山于微不境的影肩,存在高浓度的酸和高浓度的碱,可以有多种催化 方式,环境有利于反应的进行。 或形成一一个疏水环境,低介电风域: 7、多元催化和协同效应 一种酶有几种基元反应协同作用 基元反应:上述3,4,5、统称。 注意:一种晦是上述其一、其二或其几,但不是7种齐各