
粗分散系统包括乳状液、泡沫、悬浮液及悬浮体等,它们在性质上及研究方法 上与胶体分散系统有许多相似之处,故列入同一章予以讨论。胶体分散系统和粗分 散系统在生物界和非生物界都普遍存在;在实际生活和生产中均有重要应用,如在 化工、石油、治金、印染、涂料、塑料、纤维、橡胶、洗涤剂、化妆品、牙膏等生 产部门,以及在医学、生物学、土壤学、气象学、地质学、水文学、环境科学等领 域都涉及到它的原理。 本章主要研究胶体分散系统及粗分散系统的制备、性质和应用。 四.胶体分散系统及粗分散系统的研究方法 胶体分散系统及粗分散系统是一门综合性很强的学科领域,它的研究方法应 用到热力学,量子力学,统计力学以及动力学等许多学科,甚至与数学、生物学、 材料科学等所用的研究方法交叉与重叠。20世纪40年代以前,胶体理论只能对一 些现象和性质作粗略的、定性的解释:但借助量子力学的发展,应用其方法建立了 胶体间相互作用的理论(为DLV0理论的基础);同样,应用统计热力学研究大分子 溶液中大分子在固体表面上的吸附过程也取得新的进展;而应用热力学方法及动力 学方法研究溶胶的稳定性(如空间稳定理论及溶胶的聚沉速率与机理等)也是不可 缺少的方法。然而,胶体分散系统及粗分散系统这一学科领域与化学动力学相似, 仍是理论发展尚不很成熟,许多结论都强烈依靠实验来得到的正在发展的学科领 域,如现代的光散射技术、能谱技术、超显微技术、高速离心技术及电泳散射技术 等应用于胶体分散系统的实验研究,极大地推动了该学科领域的发展。 五、胶粒的结构 形成憎液溶胶的必要条件是: (1)分散相的溶解度要小: (2)还必须有稳定剂存在,否则胶粒易聚结而聚沉。 胶粒的结构比较复杂,先有一定量的难溶物分子聚结形成胶粒的中心,称为胶 核:然后胶核选择性的吸附稳定剂中的一种离子,形成紧密吸附层;由于正、负电 荷相吸,在紧密层外形成反号离子的包围圈,从而形成了带与紧密层相同电荷的胶 粒:胶粒与扩散层中的反号离子,形成一个电中性的胶团。 胶核吸附离子是有选择性的,首先吸附与胶核中相同的某种离子,用同离子效 应使胶核不易溶解。若无相同离子,则首先吸附水化能力较弱的负离子,所以自然 界中的胶粒大多带负电,如泥浆水、豆浆等都是负溶胶。 例1:AgNO3+KI→KNO+AgI↓ 过量的KI作稳定剂 胶团的结构表达式: 胶团的图示式: [(AgI)m nI-(n-x)K+]-xK 胶核 大✉ K+K 胶粒 胶核 胶团 胶粒(带负电) 胶团(电中性) 人 6
6 粗分散系统包括乳状液、泡沫、悬浮液及悬浮体等,它们在性质上及研究方法 上与胶体分散系统有许多相似之处,故列入同一章予以讨论。胶体分散系统和粗分 散系统在生物界和非生物界都普遍存在;在实际生活和生产中均有重要应用,如在 化工、石油、冶金、印染、涂料、塑料、纤维、橡胶、洗涤剂、化妆品、牙膏等生 产部门,以及在医学、生物学、土壤学、气象学、地质学、水文学、环境科学等领 域都涉及到它的原理。 本章主要研究胶体分散系统及粗分散系统的制备、性质和应用。 四. 胶体分散系统及粗分散系统的研究方法 胶体分散系统及粗分散系统是一门综合性很强的学科领域,它的研究方法应 用 到热力学,量子力学,统计力学以及动力学等许多学科,甚至与数学、生物学、 材料科学等所用的研究方法交叉与重叠。20 世纪 40 年代以前,胶体理论只能对一 些现象和性质作粗略的、定性的解释;但借助量子力学的发展,应用其方法建立了 胶体间相互作用的理论(为 DLVO 理论的基础);同样,应用统计热力学研究大分子 溶液中大分子在固体表面上的吸附过程也取得新的进展;而应用热力学方法及动力 学方法研究溶胶的稳定性(如空间稳定理论及溶胶的聚沉速率与机理等)也是不可 缺少的方法。然而,胶体分散系统及粗分散系统这一学科领域与化学动力学相似, 仍是理论发展尚不很成熟,许多结论都强烈依靠实验来得到的正在发展的学科领 域,如现代的光散射技术、能谱技术、超显微技术、高速离心技术及电泳散射技术 等应用于胶体分散系统的实验研究,极大地推动了该学科领域的发展。 五、胶粒的结构 形成憎液溶胶的必要条件是: (1)分散相的溶解度要小; (2)还必须有稳定剂存在,否则胶粒易聚结而聚沉。 胶粒的结构比较复杂,先有一定量的难溶物分子聚结形成胶粒的中心,称为胶 核;然后胶核选择性的吸附稳定剂中的一种离子,形成紧密吸附层;由于正、负电 荷相吸,在紧密层外形成反号离子的包围圈,从而形成了带与紧密层相同电荷的胶 粒;胶粒与扩散层中的反号离子,形成一个电中性的胶团。 胶核吸附离子是有选择性的,首先吸附与胶核中相同的某种离子,用同离子效 应使胶核不易溶解。若无相同离子,则首先吸附水化能力较弱的负离子,所以自然 界中的胶粒大多带负电,如泥浆水、豆浆等都是负溶胶。 例 1:AgNO3 + KI→KNO3 + AgI↓ 过量的 KI 作稳定剂 胶团的结构表达式 : 胶团的图示式: [(AgI)m n I – (n-x)K+]x– xK+ 胶核 胶粒(带负电) 胶团(电中性) 胶核 胶粒 胶团

例2:AgNO3+KI→KNO3+Agl↓ 过量的AgNO,作稳定剂 胶团的图示式: 胶团的结构表达式: [(AgI)m n Agt (n-x)NO3]x+xNO3 胶核 胶核 胶粒 胶粒(带正电) 胶团 胶团(电中性) 胶粒=胶核+被吸附离子+紧密层反离子 胶团=胶粒+扩散层反离子 胶粒的形状 作为憎液溶胶基本质点的胶粒并非都是球形,而胶粒的形状对胶体性质有重要影 响。质点为球形的,流动性较好;若为带状的,则流动性较差,易产生触变现象。 例如:(1)聚苯乙烯胶乳是球形质点 (2) V,O5溶胶是带状的质点 (3)Fe(OH3溶胶是丝状的质点 >
7 例2:AgNO3 + KI → KNO3 + AgI↓ [(AgI)m n Ag+ (n-x)NO3 – ]x+ x NO3 – 胶核 胶粒 胶团 胶团的图示式: 胶核 胶粒(带正电) 胶团(电中性) 过量的 AgNO3 作稳定剂 胶团的结构表达式: 胶粒 = 胶核 +被吸附离子 + 紧密层反离子 胶团 = 胶粒 + 扩散层反离子 胶粒的形状 作为憎液溶胶基本质点的胶粒并非都是球形,而胶粒的形状对胶体性质有重要影 响。质点为球形的,流动性较好;若为带状的,则流动性较差,易产生触变现象。 例如:(1)聚苯乙烯胶乳是球形质点 (2) V2O5 溶胶是带状的质点 (3) Fe(OH)3 溶胶是丝状的质点
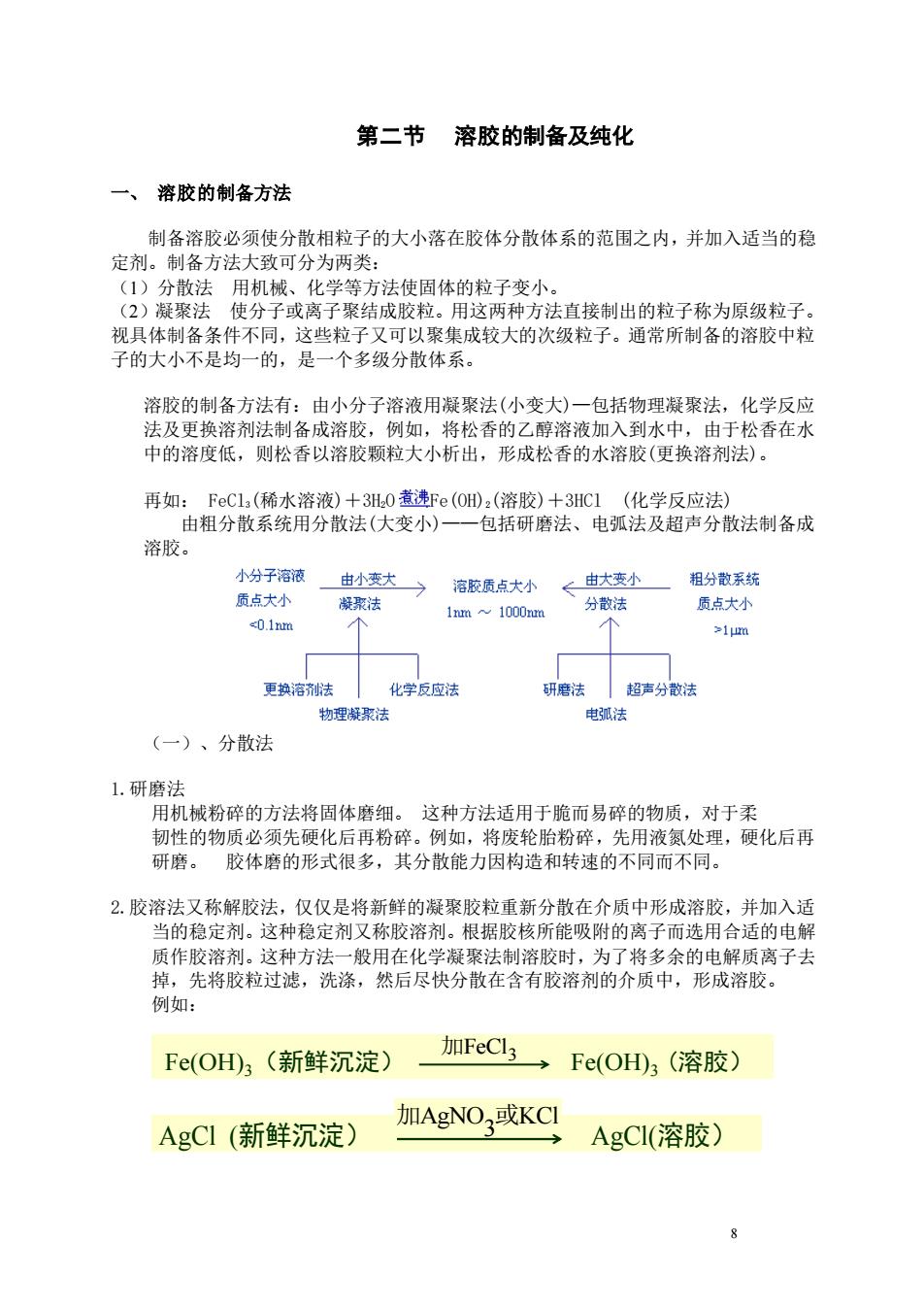
第二节溶胶的制备及纯化 一、 溶胶的制备方法 制备溶胶必须使分散相粒子的大小落在胶体分散体系的范围之内,并加入适当的稳 定剂。制备方法大致可分为两类: (1)分散法用机械、化学等方法使固体的粒子变小。 (2)凝聚法使分子或离子聚结成胶粒。用这两种方法直接制出的粒子称为原级粒子。 视具体制备条件不同,这些粒子又可以聚集成较大的次级粒子。通常所制备的溶胶中粒 子的大小不是均一的,是一个多级分散体系。 溶胶的制备方法有:由小分子溶液用凝聚法(小变大)一包括物理凝聚法,化学反应 法及更换溶剂法制备成溶胶,例如,将松香的乙醇溶液加入到水中,由于松香在水 中的溶度低,则松香以溶胶颗粒大小析出,形成松香的水溶胶(更换溶剂法)。 再如:FeC13(稀水溶液)+3H20煮沸Fe(OH)2(溶胶)+3HC1(化学反应法) 由粗分散系统用分散法(大变小)一一包括研磨法、电弧法及超声分散法制备成 溶胶。 小分子溶液 由小变大 溶胶质点大小 ←由大变小 粗分散系统 质点大小 凝聚法 1nm~1000nm 分散法 质点大小 -0.1nm >1m 更换溶剂法 化学反应法 研磨法 超声分散法 物理凝聚法 电弧法 (一)、分散法 1.研磨法 用机械粉碎的方法将固体磨细。这种方法适用于脆而易碎的物质,对于柔 韧性的物质必须先硬化后再粉碎。例如,将废轮胎粉碎,先用液氮处理,硬化后再 研磨。胶体磨的形式很多,其分散能力因构造和转速的不同而不同。 2.胶溶法又称解胶法,仅仅是将新鲜的凝聚胶粒重新分散在介质中形成溶胶,并加入适 当的稳定剂。这种稳定剂又称胶溶剂。根据胶核所能吸附的离子而选用合适的电解 质作胶溶剂。这种方法一般用在化学凝聚法制溶胶时,为了将多余的电解质离子去 掉,先将胶粒过滤,洗涤,然后尽快分散在含有胶溶剂的介质中,形成溶胶。 例如: Fe(OHD3(新鲜沉淀) 加FeCl3 Fe(OH3(溶胶) AgCI(新鲜沉淀) 加AgNO,或KCI AgCI(溶胶) 8
8 第二节 溶胶的制备及纯化 一、 溶胶的制备方法 制备溶胶必须使分散相粒子的大小落在胶体分散体系的范围之内,并加入适当的稳 定剂。制备方法大致可分为两类: (1)分散法 用机械、化学等方法使固体的粒子变小。 (2)凝聚法 使分子或离子聚结成胶粒。用这两种方法直接制出的粒子称为原级粒子。 视具体制备条件不同,这些粒子又可以聚集成较大的次级粒子。通常所制备的溶胶中粒 子的大小不是均一的,是一个多级分散体系。 溶胶的制备方法有:由小分子溶液用凝聚法(小变大)—包括物理凝聚法,化学反应 法及更换溶剂法制备成溶胶,例如,将松香的乙醇溶液加入到水中,由于松香在水 中的溶度低,则松香以溶胶颗粒大小析出,形成松香的水溶胶(更换溶剂法)。 再如: FeCl3(稀水溶液)+3H2O Fe(OH)2(溶胶)+3HCl (化学反应法) 由粗分散系统用分散法(大变小)——包括研磨法、电弧法及超声分散法制备成 溶胶。 (一)、分散法 1.研磨法 用机械粉碎的方法将固体磨细。 这种方法适用于脆而易碎的物质,对于柔 韧性的物质必须先硬化后再粉碎。例如,将废轮胎粉碎,先用液氮处理,硬化后再 研磨。 胶体磨的形式很多,其分散能力因构造和转速的不同而不同。 2.胶溶法又称解胶法,仅仅是将新鲜的凝聚胶粒重新分散在介质中形成溶胶,并加入适 当的稳定剂。这种稳定剂又称胶溶剂。根据胶核所能吸附的离子而选用合适的电解 质作胶溶剂。这种方法一般用在化学凝聚法制溶胶时,为了将多余的电解质离子去 掉,先将胶粒过滤,洗涤,然后尽快分散在含有胶溶剂的介质中,形成溶胶。 例如: Fe(OH)3(新鲜沉淀) Fe(OH) 3 3 (溶胶) 加FeCl AgCl (新鲜沉淀) AgCl(溶胶) AgNO KCl 3 加 或 AgCl (新鲜沉淀) AgCl(溶胶) AgNO KCl 3 加 或

3.超声分散法这种方法目前只用来制备乳状液。 如图所示,将分散相和分散介质两种不混溶的液体放在样品管4中。样品管固定 在变压器油浴中。在两个电极上通入高频电流,使电极中间的石英片发生机械振 荡,使管中的两个液相均匀地混合成乳状液。 1.石英片2电极 翻 3.变压器油4.盛试样的试管 超声波分散法 弧法 4.电弧法 电弧法主要用于制备金、银、铂等金属溶胶。制备过程包括先分散后凝聚两个过 程。将金属做成两个电极,浸在水中,盛水的盘子放在冷浴中。在水中加入少量NOH 作为稳定剂。制备时在两电极上施加100V左右的直流电,调节电极之间的距离, 使之发生电火花,这时表面金属蒸发,是分散过程,接着金属蒸气立即被水冷却而 凝聚为胶粒。 (二)凝聚法 1.化学凝聚法 通过各种化学反应使生成物呈过饱和状态,使初生成的难溶物微粒结合成胶粒, 在少量稳定剂存在下形成溶胶,这种稳定剂一般是某一过量的反应物。例如: A.复分解反应制硫化砷溶胶 2H3AsO3(稀)+3H2S→As2S3(溶胶)+6H2O B.水解反应制氢氧化铁溶胶 FeCl3(稀)+3H2O(热)→Fe(OH)3(溶胶)+3HCI
9 3.超声分散法 这种方法目前只用来制备乳状液。 如图所示,将分散相和分散介质两种不混溶的液体放在样品管 4 中。样品管固定 在变压器油浴中。在两个电极上通入高频电流,使电极中间的石英片发生机械振 荡,使管中的两个液相均匀地混合成乳状液。 4.电弧法 电弧法主要用于制备金、银、铂等金属溶胶。制备过程包括先分散后凝聚两个过 程。将金属做成两个电极,浸在水中,盛水的盘子放在冷浴中。在水中加入少量 NaOH 作为稳定剂。制备时在两电极上施加 100V 左右的直流电,调节电极之间的距离, 使之发生电火花,这时表面金属蒸发,是分散过程,接着金属蒸气立即被水冷却而 凝聚为胶粒。 (二)凝聚法 1.化学凝聚法 通过各种化学反应使生成物呈过饱和状态,使初生成的难溶物微粒结合成胶粒, 在少量稳定剂存在下形成溶胶,这种稳定剂一般是某一过量的反应物。例如: A.复分解反应制硫化砷溶胶 2H3AsO3 (稀) + 3H2S →As2S3 (溶胶) + 6H2O B.水解反应制氢氧化铁溶胶 FeCl3 (稀) +3H2O(热)→ Fe(OH)3 (溶胶) + 3HCl

C.氧化还原反应制备硫溶胶 2H2S(稀)+SO2(g)→2H2O+3S(溶胶) Na2S2O3+2HC1→2NaC1+H,O+SO,+S(溶胶) D还原反应制金溶胶 2HAuCl()+3HCHO+11KOH A>2Au(溶胶)+3 HCOOK+8KC1+8H2O E离子反应制氯化银溶胶 AgNO3(稀)+KC1(稀)→AgCI(溶胶)+KNO3 2.物理凝聚法 A.更换溶剂法 利用物质在不同溶剂中溶解度的显著差别来制备溶胶,而且两种溶剂要能完全互溶。 例1.松香易溶于乙醇而难溶于水,将松香的乙醇溶液滴入水中可制备松香的水溶胶。 例2.将硫的丙酮溶液滴入90℃左右的热水中,丙酮蒸发后,可得硫的水溶胶。 B.蒸气骤冷法 将汞的蒸气通入冷水中就可以得到汞的水溶胶 二.溶胶的纯化 在制备溶胶的过程中,常生成一些多余的电解质,如制备F(OH)3溶胶时生成 的HC1。未经纯化的溶胶往往含有很多电解质或其他杂质。少量的电解质可以使溶 胶质点因吸附离子而带电,因而对于稳定溶胶是必要的。少量电解质可以作为溶胶 的稳定剂,但是过量的电解质对溶胶的稳定反而有害,会使溶胶不稳定,容易聚沉。 因此,溶胶制得后需经纯化处理。净化的方法主要有渗析法和超过滤法。 最常用的纯化方法是渗析,有简单渗析和电渗析。 简单渗析利用溶胶质点不能透过半透膜,而离子或小分子能透过膜的性质,将 多余的电解质或低分子化合物等杂质从溶胶中除去。常用的半透膜有火棉胶膜,醋 酸纤维膜等。 电渗析为了加快渗析速度,在装有溶胶的半透膜两侧外加一个电场,使多余的 电解质离子向相应的电极作定向移动。溶剂水不断自动更换,这样可以提高净化速 度。这种方法称为电渗析法。 纯化溶胶的另一种方法是超过滤法。超过滤是用孔径极小而孔数极多的膜片作 为滤膜,利用压差使溶胶流经超过滤器。这时,溶胶质点与介质迅速分离,杂质透 过滤膜而除掉。将半透膜上的胶粒迅速用含有稳定剂的介质再次分散。 电超过滤有时为了加快过滤速度,在半透膜两边安放电极,施以一定电压, 使电渗析和超过滤合并使用,这样可以降低超过滤压力。 0
10 C.氧化还原反应制备硫溶胶 2H2S(稀)+ SO2(g) → 2H2O +3S (溶胶) Na2S2O3 +2HCl → 2NaCl +H2O +SO2 +S (溶胶) E.离子反应制氯化银溶胶 AgNO3(稀)+ KCl(稀) → AgCl(溶胶) +KNO3 D.还原反应制金溶胶 2HAuCl4(稀)+ 3HCHO +11KOH ⎯→ 2Au(溶胶)+3HCOOK + 8KCl + 8H2O D.还原反应制金溶胶 2HAuCl4(稀)+ 3HCHO +11KOH ⎯→ 2Au(溶胶)+3HCOOK + 8KCl + 8H2O 2.物理凝聚法 A. 更换溶剂法 利用物质在不同溶剂中溶解度的显著差别来制备溶胶,而且两种溶剂要能完全互溶。 例 1.松香易溶于乙醇而难溶于水,将松香的乙醇溶液滴入水中可制备松香的水溶胶 。 例 2.将硫的丙酮溶液滴入 90℃左右的热水中,丙酮蒸发后,可得硫的水溶胶。 B.蒸气骤冷法 将汞的蒸气通入冷水中就可以得到汞的水溶胶 二.溶胶的纯化 在制备溶胶的过程中,常生成一些多余的电解质,如制备 Fe(OH)3溶胶时生成 的 HCl。未经纯化的溶胶往往含有很多电解质或其他杂质。少量的电解质可以使溶 胶质点因吸附离子而带电,因而对于稳定溶胶是必要的。少量电解质可以作为溶胶 的稳定剂,但是过量的电解质对溶胶的稳定反而有害,会使溶胶不稳定,容易聚沉。 因此,溶胶制得后需经纯化处理。净化的方法主要有渗析法和超过滤法。 最常用的纯化方法是渗析,有简单渗析和电渗析。 简单渗析利用溶胶质点不能透过半透膜,而离子或小分子能透过膜的性质,将 多余的电解质或低分子化合物等杂质从溶胶中除去。常用的半透膜有火棉胶膜,醋 酸纤维膜等。 电渗析为了加快渗析速度,在装有溶胶的半透膜两侧外加一个电场,使多余的 电解质离子向相应的电极作定向移动。溶剂水不断自动更换,这样可以提高净化速 度。这种方法称为电渗析法。 纯化溶胶的另一种方法是超过滤法。超过滤是用孔径极小而孔数极多的膜片作 为滤膜,利用压差使溶胶流经超过滤器。这时,溶胶质点与介质迅速分离,杂质透 过滤膜而除掉。将半透膜上的胶粒迅速用含有稳定剂的介质再次分散。 电超过滤 有时为了加快过滤速度,在半透膜两边安放电极,施以一定电压, 使电渗析和超过滤合并使用,这样可以降低超过滤压力