
化学动力学发展简史 19世纪后半叶,宏观反应动力学阶段。主要成就 是质量作用定律和Arrhenius公式的确立,提出了 活化能的概念。 20世纪前叶,宏观反应动力学向微观反应动力 学过渡阶段 20世纪50年代,微观反应动力学阶段。对反应 速率从理论上进行了探讨,提出了碰撞理论和过 渡态理论,建立了势能面。发现了链反应,从总 包反应向基元反应过渡。由于分子束和激光技术 的发展,开创了分子反应动态学
•19世纪后半叶,宏观反应动力学阶段。主要成就 是质量作用定律和Arrhenius公式的确立,提出了 活化能的概念。 化学动力学发展简史 •20世纪50年代,微观反应动力学阶段。对反应 速率从理论上进行了探讨,提出了碰撞理论和过 渡态理论,建立了势能面。发现了链反应,从总 包反应向基元反应过渡。由于分子束和激光技术 的发展,开创了分子反应动态学。 •20世纪前叶,宏观反应动力学向微观反应动力 学过渡阶段

§11.2 化学反应速率的表示法 速度 velocity 是矢量,有方向性。 速率 rate 是标量,无方向性,都是正值。 例如: R→P 速度 d[R] <0 d P dt dt 速率 d[R] dP]>0 dt dt
§11.2 化学反应速率的表示法 速度 velocity 是矢量,有方向性。 速率 rate 是标量 ,无方向性,都是正值。 d[R] d[P] 0 0 d d t t 速度 d[R] d[P] 0 d d t t 速率 − = 例如: R P ⎯⎯→
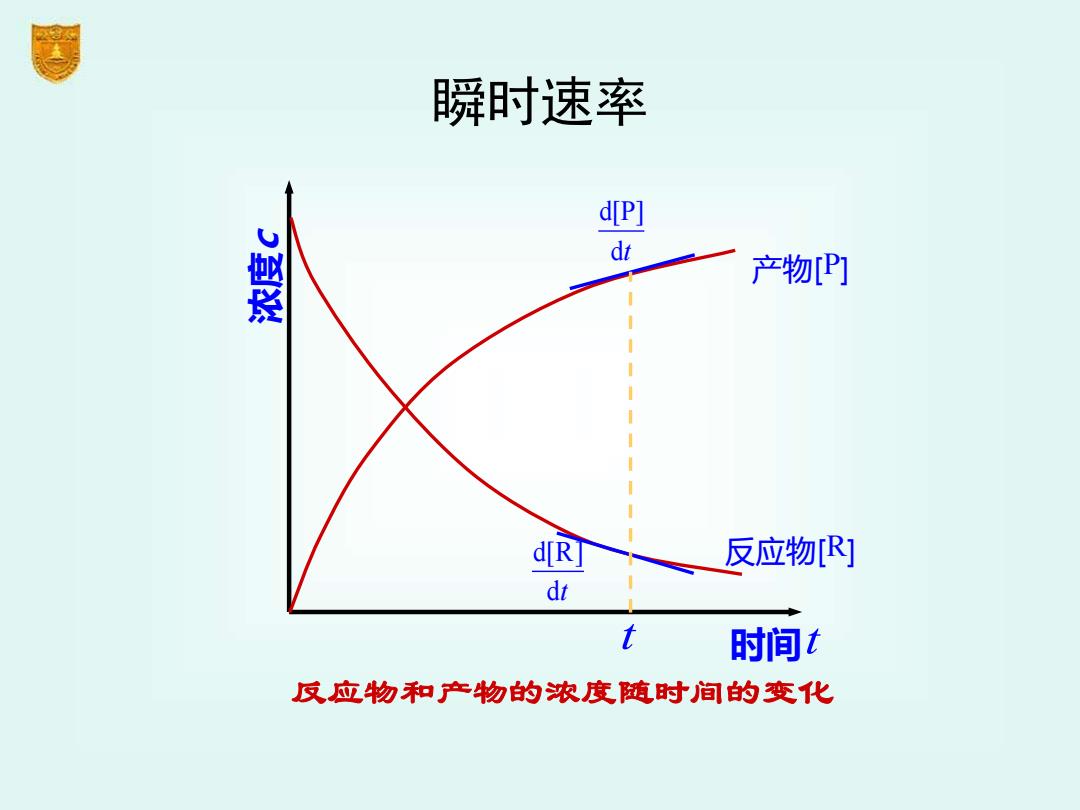
2 瞬时速率 d[P] dt 产物P] i d[RJ 反应物[R] dt t 时间t 反应物和产物的浓度随时间的变化
瞬时速率 浓度 c 时间 t 反应物[R] d[P] dt d[R] dt 反应物和产物的浓度随时间的变化 产物[P] t
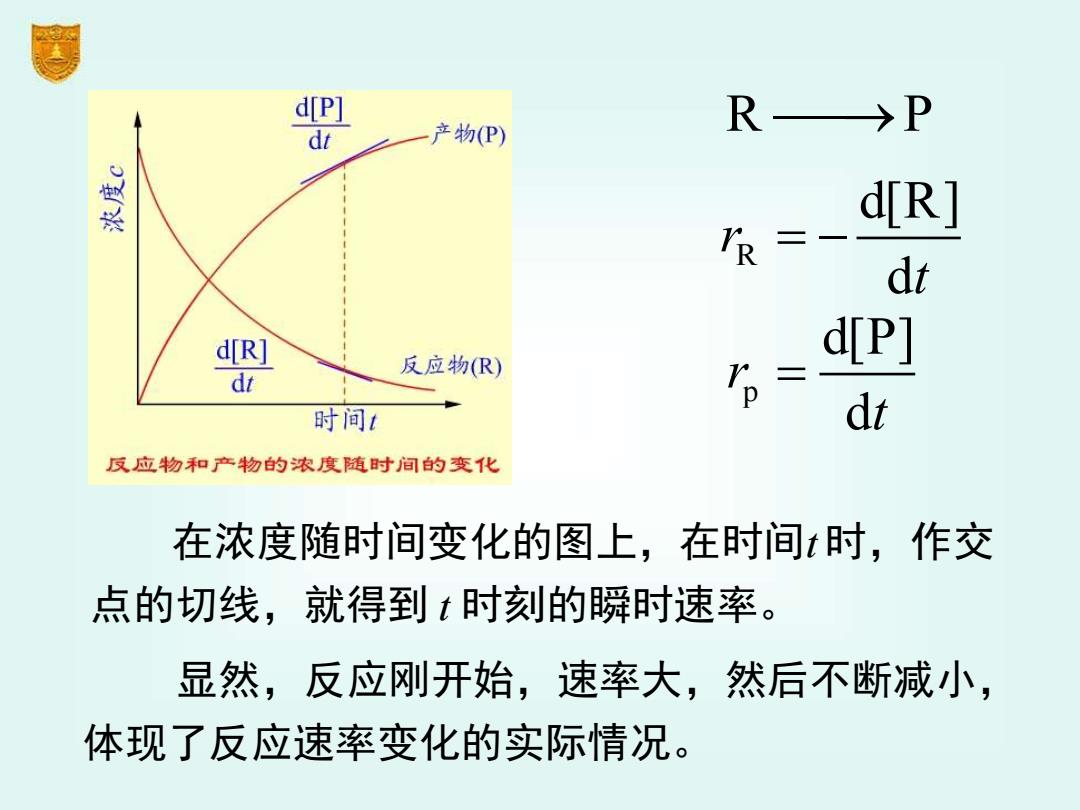
d[P] 一产物(P) →P R d[R] /R= dt d[R] 反应物(R) d[P] dt ,= 时间1 dt 反应物和产物的浓度随时间的变化 在浓度随时间变化的图上,在时间t时,作交 点的切线,就得到t时刻的瞬时速率。 显然,反应刚开始,速率大,然后不断减小, 体现了反应速率变化的实际情况
R P ⎯⎯→ 在浓度随时间变化的图上,在时间t 时,作交 点的切线,就得到 t 时刻的瞬时速率。 R d[R] d r t = − p d[P] d r t = 显然,反应刚开始,速率大,然后不断减小, 体现了反应速率变化的实际情况

反应进度(extent of reaction) 设反应为: R→BP t=0nR(0) p(0) i=t n(t) n,(t) 5-②-(0) _n,(t)-np(0) Q d5= dns VB
反应进度(extent of reaction) 设反应为: R P ⎯⎯→ R P 0 (0) (0) t n n = R p t t n t n t = ( ) ( ) R R p P n t n ( ) (0) ( ) (0) n t n − − = = − B B d d n =