重庆医科大学药学院教案 课程名称无机化学 授课 年级 2008级 校果对家器分、可 授课教师 蒋心惠 职称副教授 授课方式课堂讲授 学时5 授课题目 第五章化学平衡 教材名称、 许善锦主编《无机化学》 人民卫生出版社第四版 学 了解标准平衡常数及其表示方法掌握化学反应等温式,掌握自由能与标准平衡常数的关 系及应用:熟悉浓度、压力、温度对化学平衡的影响 要 求 标准平衡常数和吉布斯能改变,范特霍夫等温式,多重平衡 占 教 化学平衡常数,化学平衡的移动 占 外语 要求 reversible reaction,chemical equilibrium,multiple equilibrium,shift of chemical equilibrium 教学 方法 结合CAI课件,课堂讲授为主,在中学的知识的基础上扩展和提高。 手段 习题 1-14 作业 复习 参考 配套教材《无机化学学习指导》 资料 课后 教学 小结
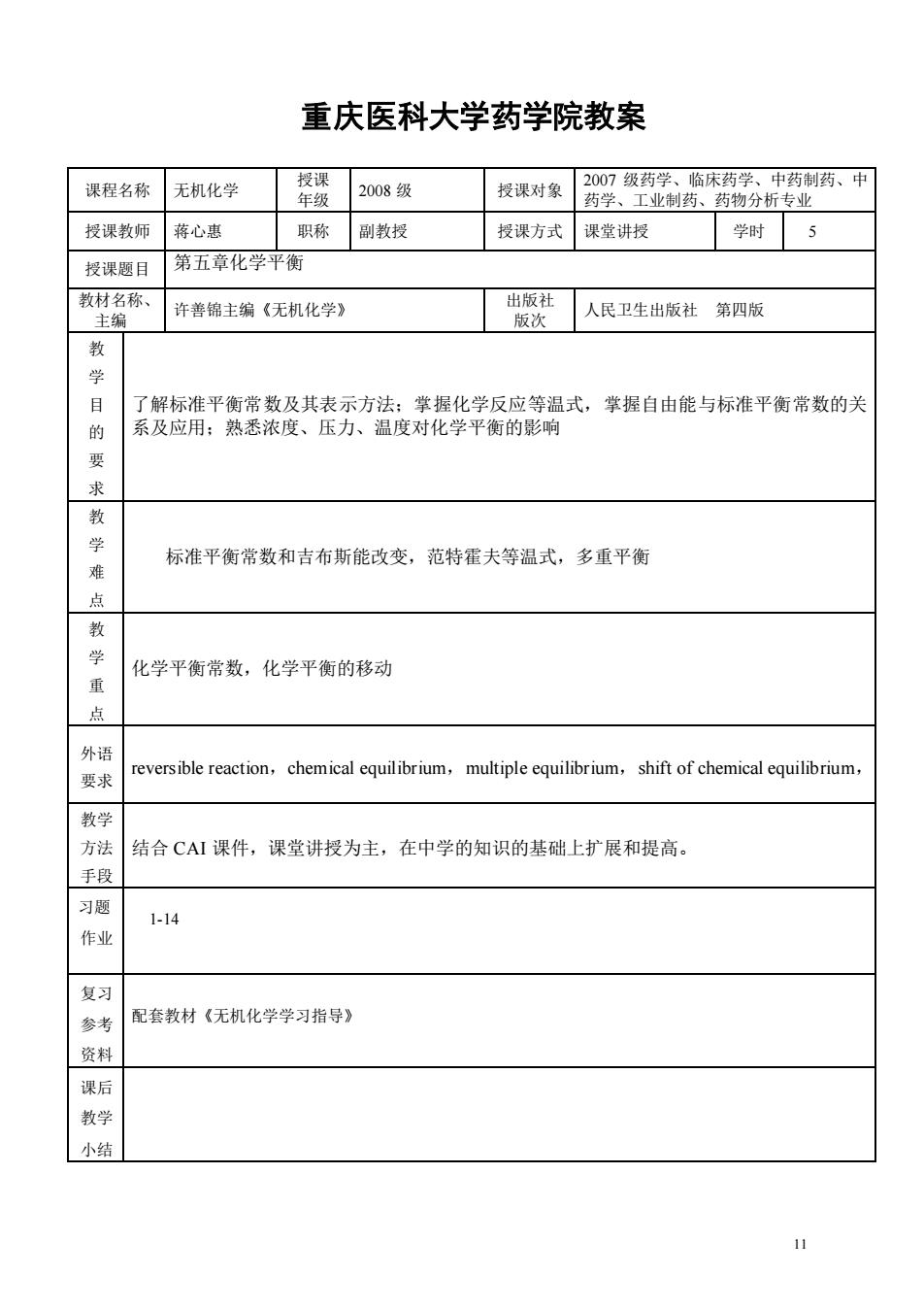
11 重庆医科大学药学院教案 课程名称 无机化学 授课 年级 2008 级 授课对象 2007 级药学、临床药学、中药制药、中 药学、工业制药、药物分析专业 授课教师 蒋心惠 职称 副教授 授课方式 课堂讲授 学时 5 授课题目 第五章化学平衡 教材名称、 主编 许善锦主编《无机化学》 出版社 版次 人民卫生出版社 第四版 教 学 目 的 要 求 了解标准平衡常数及其表示方法;掌握化学反应等温式,掌握自由能与标准平衡常数的关 系及应用;熟悉浓度、压力、温度对化学平衡的影响 教 学 难 点 标准平衡常数和吉布斯能改变,范特霍夫等温式,多重平衡 教 学 重 点 化学平衡常数,化学平衡的移动 外语 要求 reversible reaction,chemical equilibrium,multiple equilibrium,shift of chemical equilibrium, 教学 方法 手段 结合 CAI 课件,课堂讲授为主,在中学的知识的基础上扩展和提高。 习题 作业 1-14 复习 参考 资料 配套教材《无机化学学习指导》 课后 教学 小结

教学 时间 进程 分配 化学反应的终点:达到平衡。 第一节110分钟 第一节 平衡常数 一、化学反应的可逆性和化学平衡 10分钟 化学反应的可逆性 化学平衡: 在化学中,把正反应速率和逆反应速率相等时体系所处的状态叫 做化学平衡。 二、平衡常数 40分钟 平衡常数表达式: 浓度平衡常数和压力平衡常数 INH.P 心K Kc叫做浓度平衡常数 也可用平衡时混合气体中各物质分压间的关系来表示,即 Kp叫做压力平衡常数。 K。=K(RT) 书写和应用平衡常数时应注意的几点: (1)在平衡常数表达式中各物质的浓度或分压力,都是指平衡时 的浓度或分压力,并且反应物的浓度或分压力要写成分母,反应 产物的浓度或分压力则写做分子。 (2)如果在反应体系中有固体或纯液体参加时,其浓度可认为是 常数,均不写进平衡常数表达式中。 (3)在稀溶液中进行的反应,虽有溶剂例如水参与反应,但浓度 几乎维持不变,所以也不列入表达式中;但如果水仅作为反应物 或生成物的一个组分,则要写入平衡常数表达式。 (4)平衡常数表达式必须与反应方程式相对应。反应式的写法不 同,平衡常数表达式不同,平衡常数值也不同。 (5)正逆反应的平衡常数值互为倒数 某反应物的转化率= 的物质的量x100% 某反应物起始的物质的量 三、标准平衡常数和吉布斯能变 对气体反应 40分钟
12 教 学 进 程 时间 分配 化学反应的终点:达到平衡。 第一节 平 衡 常 数 一、化学反应的可逆性和化学平衡 化学反应的可逆性 化学平衡: 在化学中,把正反应速率和逆反应速率相等时体系所处的状态叫 做化学平衡。 二、平衡常数 平衡常数表达式: 浓度平衡常数和压力平衡常数 Kc N H NH = 3 2 2 2 3 [ ][ ] [ ] Kc 叫做浓度平衡常数。 也可用平衡时混合气体中各物质分压间的关系来表示,即 Kp 叫做压力平衡常数。 p N H K p p p NH = 3 [ ] [ ] 2 2 2 [ 3 ] n Kp Kc RT = • ( ) 书写和应用平衡常数时应注意的几点: (l)在平衡常数表达式中各物质的浓度或分压力,都是指平衡时 的浓度或分压力,并且反应物的浓度或分压力要写成分母,反应 产物的浓度或分压力则写做分子。 (2)如果在反应体系中有固体或纯液体参加时,其浓度可认为是 常数,均不写进平衡常数表达式中。 (3)在稀溶液中进行的反应,虽有溶剂例如水参与反应,但浓度 几乎维持不变,所以也不列入表达式中;但如果水仅作为反应物 或生成物的一个组分,则要写入平衡常数表达式。 (4)平衡常数表达式必须与反应方程式相对应。反应式的写法不 同,平衡常数表达式不同,平衡常数值也不同。 (5)正逆反应的平衡常数值互为倒数。 = 100% 某反应物起始的物质的量 某反应物已转化的物质的量 某反应物的转化率 三、标准平衡常数和吉布斯能变 对气体反应 第一节 110 分钟 10 分钟 40 分钟 40 分钟

aA (g)+bB (g) dD(g)+eE(g) Van't Hoff等温式: △.G=△,G+2.303RTg (Polp(PElp (palp(Palp (Polp(PlpY palp)P(Pa/p泸 =0。 Q,叫做起始分压商,简称反应商。 △.G=△G°+2.303RTgQ -△G=2.303RTgK lg K=- 4,G9 2.303R7 对于溶液中进行的反应,同样有 -△,G°=2.303RTgK 或 eK2=2303R7 △,G Q。<K,Q./K<1,则△,G<0,正向反应自发进行: Q。=K,Qn1K=1,则△,G=0,反应处于平衡状态: Q)K,Q,/K1,则△,G”>0,逆反应自发进行。 标准平衡常数的计算和应用。用例题说明。 20分钟 四、多重平 多重平衡规则 第二节 化学平衡的移动 第二节90分钟 由于外界条件的改变,使可逆反应从一种平衡状态向另一种平衡 状态转变的过程,叫做化学平衡的移动。 一、浓度对化学平衡的影响:(核心,平衡常数不变) 9 二、压力对化学平衡的影响:原理与浓度的影响相同 20 (计算说明,结合中学的知识)例10 三.温度对化学平衡的影响 % 平衡数的整」 g=- △H9 4S9 2.303RT 2303R+2303R g △,H-五 强调催化剂不改变平衡 10 从热力学和动力学等两方面米选择合理的生产条件 反应速率和反应转化率间可能存在的矛盾
13 aA(g)+ bB(g) dD(g)+ eE(g) Van’t Hoff 等温式: b B a A A e E d D r r B D E p p p p p p p p G G RT ( / ) ( / ) ( / ) ( / ) 2.303 lg • • = + b p B a A A e E d D Q p p p p p p p p B D E = • • ( / ) ( / ) ( / ) ( / ) Qp 叫做起始分压商,简称反应商。 rG rG RT Qp = + 2.303 lg rG RT Kp − = 2.303 lg RT G K r p 2.303 lg = − 对于溶液中进行的反应,同样有 rG RT Kc − = 2.303 lg 或 RT G K r c 2.303 lg = − , / 1 Qp Kp Qp Kp ,则 rG < 0,正向反应自发进行; = , / =1 Qp Kp Qp Kp ,则 rG = 0,反应处于平衡状态; , / 1 Qp Kp Qp Kp ,则 rG > 0,逆反应自发进行。 标准平衡常数的计算和应用。用例题说明。 四、多 重 平 衡 多重平衡规则 第二节 化学平衡的移动 由于外界条件的改变,使可逆反应从一种平衡状态向另一种平衡 状态转变的过程,叫做化学平衡的移动。 一、浓度对化学平衡的影响:(核心,平衡常数不变) 二、压力对化学平衡的影响:原理与浓度的影响相同 (计算说明,结合中学的知识)例 10 三.温度对化学平衡的影响 平衡常数的改变 R S RT H RT H T S k r r r r p 2.303 2.303 2.303 lg + = − − = − • − = 1 2 1 2 2.303 lg 2 1 T T T T R H k k r p p 例 11 强调催化剂不改变平衡 从热力学和动力学等两方面来选择合理的生产条件 反应速率和反应转化率间可能存在的矛盾。 20 分钟 第二节 90 分钟 20 20 40 10

重庆医科大学药学院教案 课程名称无机化学 授课 2008级 授课对象007级药学,临床药学、中药制药、中 年级 药学、工业制药、药物分析专业 授课牧师 蒋心惠 职称 副牧授 授课方式课堂讲授 学时10 授课题目第六章酸碱平衡 许善锦主编《无机化学》 出社 人民卫生出版社第四版 教 1. 握酸碱质子理论的基本内容及其应用掌握一元弱酸、弱碱溶液中H*浓度(或OH 学 浓度)和pH值的计算方法:掌握缓冲溶液的概念、组成、和缓冲作用的机理;掌握影响缓 冲溶液pH值的因素和亨德生方程。 2.熟悉多元弱酸、弱碱以及两性溶液中H+浓度(或O什浓度)和H值的计算方法:熟悉 的 同离子效应及其有关计算:熟悉缓冲容量与缓冲溶液总浓度和缓冲比的关系:熟悉缓冲溶 要 液的配制原则、方法和步骤 求 3.了解盐效应的涵义:了解血液中的缓冲系及作用原理。 教 学 水溶液中质子转移平衡的有关计算;缓冲溶液配制的相关计算。 教 酸碱质子理论的基本要点:酸碱溶液pH值的计算:同离子效应:缓冲溶液的作用原理;缓 重 冲溶液pH值的计算公式及应用。 占 外语 Acid,base,proton,conjugate pair of acid-base,ionization equilibrium of weak acid and weak 要求 base.acidity productacidity.alkalinity,buffersolution 教学 方法 结合CAI课件,课堂讲授为主,在中学的知识的基础上扩展和提高。 手段 习题 作业 1-10,12-17 复习 参考 配套教材《无机化学学习指导》 资料 课后 教学 小结 14
14 重庆医科大学药学院教案 课程名称 无机化学 授课 年级 2008 级 授课对象 2007 级药学、临床药学、中药制药、中 药学、工业制药、药物分析专业 授课教师 蒋心惠 职称 副教授 授课方式 课堂讲授 学时 10 授课题目 第六章 酸碱平衡 教材名称、 主编 许善锦主编《无机化学》 出版社 版次 人民卫生出版社 第四版 教 学 目 的 要 求 1.掌握酸碱质子理论的基本内容及其应用;掌握一元弱酸、弱碱溶液中 H+浓度(或 OH- 浓度)和 pH 值的计算方法;掌握缓冲溶液的概念、组成、和缓冲作用的机理;掌握影响缓 冲溶液 pH 值的因素和亨德生方程。 2.熟悉多元弱酸、弱碱以及两性溶液中 H+浓度(或 OH-浓度)和 pH 值的计算方法;熟悉 同离子效应及其有关计算;熟悉缓冲容量与缓冲溶液总浓度和缓冲比的关系;熟悉缓冲溶 液的配制原则、方法和步骤。 3.了解盐效应的涵义;了解血液中的缓冲系及作用原理。 教 学 难 点 水溶液中质子转移平衡的有关计算;缓冲溶液配制的相关计算。 教 学 重 点 酸碱质子理论的基本要点;酸碱溶液 pH 值的计算;同离子效应;缓冲溶液的作用原理;缓 冲溶液 pH 值的计算公式及应用。 外语 要求 Acid, base, proton, conjugate pair of acid-base, ionization equilibrium of weak acid and weak base, acidity constant, ionic product, acidity, alkalinity, buffer solution 教学 方法 手段 结合 CAI 课件,课堂讲授为主,在中学的知识的基础上扩展和提高。 习题 作业 1-10,12-17 复习 参考 资料 配套教材《无机化学学习指导》 课后 教学 小结