
第4章酸碱滴定法
1 第4章 酸碱滴定法

4.1酸碱反应及其平衡常数 4.1.1酸碱反应 酸 共轭碱 质子 HAc Ac + NH4* NHg + HCO3 111111 C032- H6Y2+ HsY+ + 酸碱半反应 通式:HA A- + H 共轭酸 碱 + 质子 2
2 4.1 酸碱反应及其平衡常数 4.1.1 酸碱反应 酸 共轭碱 + 质子 HAc Ac- + H+ NH4 + NH3 + H+ HCO3 - CO3 2- + H+ H6Y2+ H5Y+ + H+ 通式: HA A— + H+ 共轭酸 碱 + 质子 酸 碱 半 反 应
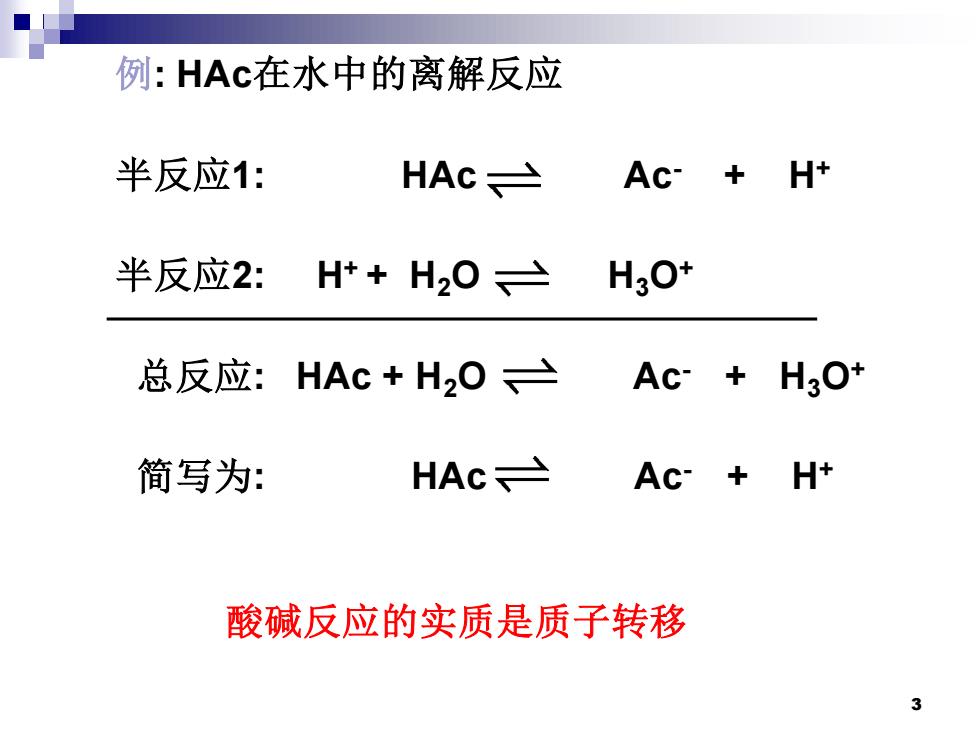
例:HAc在水中的离解反应 半反应1: HAc≥ Ac-+H+ 半反应2:Ht+H20≥ H3O* 总反应:HAc+H2O≥ Ac+H3O* 简写为: HAc≌ Ac-+H+ 酸碱反应的实质是质子转移 3
3 例: HAc在水中的离解反应 半反应1: HAc Ac- + H+ 半反应2: H+ + H2O H3O+ 总反应: HAc + H2O Ac- + H3O+ 简写为: HAc Ac- + H+ 酸碱反应的实质是质子转移

3.1.2酸碱反应类型及平衡常数 a.一元弱酸碱的离解反应 HA H2O A-+H3O+ E,=a(H)a(A) a(HA) A-+H2O≥HA+OH K。=aHA)a(OH) a(A) 4
4 3.1.2 酸碱反应类型及平衡常数 a. 一元弱酸碱的离解反应 + a (H ) (A ) (HA) a a K a − = − HA + H2O A — + H3O+ A — + H2O HA + OH — b (HA) (OH ) (A) a a K a − =

b.水的质子自递反应: H20+H20≥H3O++OH (25°C) Kw=a(H)a(0H)=1.00x10-4 共轭酸碱对(HA-A一)的K与K的关系为: k-lgaa)- a灯 a(A) pKa+pkp pKw =14.00 5
5 b. 水的质子自递反应: H2O + H2O H3O+ + OH- (25°C) p p p 14.00 K K K a b w + = = 14 w K a a (H ) (OH ) 1.00 10 + − − = = + - a b w - (H ) (A ) (HA) (OH ) (HA) (A ) a a a a K K K a a − = = 共轭酸碱对(HA-A-)的Ka与Kb的关系为 :