
酸碱解离平衡 1、酸碱溶质与溶剂分子间的反应一酸碱的解离 HA+HO≥A+H,O HA≌H+A K,=H,O][A]/[HA] K。=H][A]/HA] K。一酸的解离常数 B+H,O≌HB+OH K。—碱的解离常数 K,=[HB][OH-]/[B-] 2、溶剂分子之间的质子转移反应 H,O+H,O=H,O+OH H,O、≥H+OH K.=H][OH]=1.0×10-14K一水的离子积常数 出本程子大军 Analytical Chemistry 6
Analytical Chemistry 6 酸碱解离平衡 2 3 3 H A H O A H O [H O ][A ] /[H A] K a B H O H B OH 2 [H B][OH ] /[B ] Kb 1、酸碱溶质与溶剂分子间的反应—酸碱的解离 H A H A [H ][A ] /[H A] K a Ka—酸的解离常数 Kb—碱的解离常数 H2 O H2 O H3 O OH 2、溶剂分子之间的质子转移反应 14 [H ][OH ] 1.0 10 K w H O H OH 2 Kw—水的离子积常数
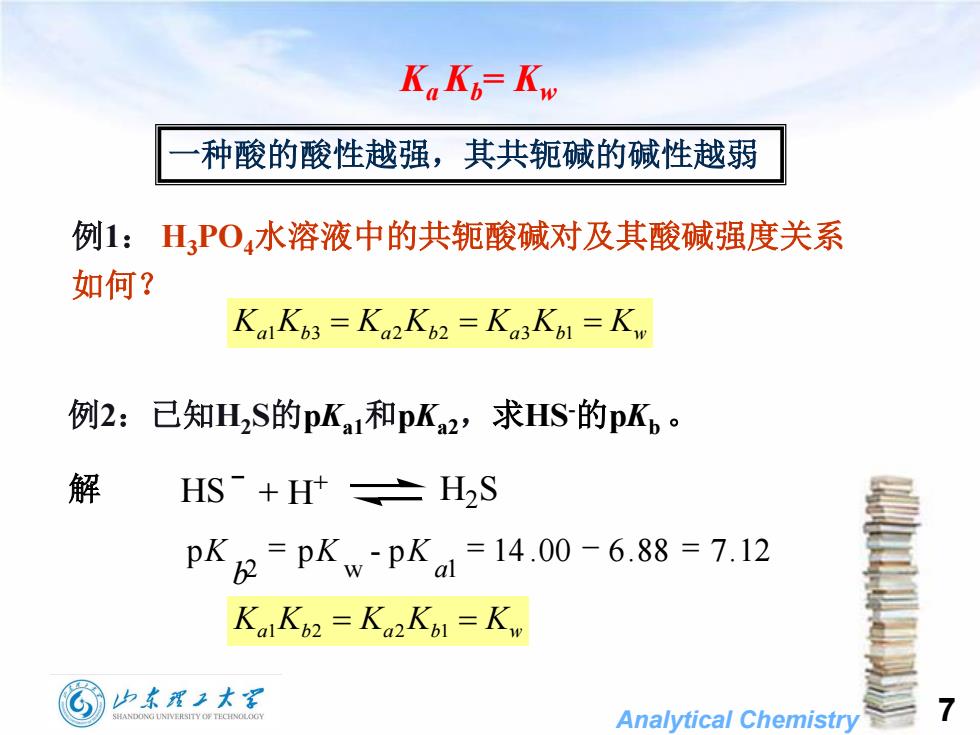
Ka Kp=Kw 种酸的酸性越强,其共轭碱的碱性越弱 例1:H,PO,水溶液中的共轭酸碱对及其酸碱强度关系 如何? Kal Kb3=Ka2K62 Ka3 Kbl Kyv 例2:已知HS的pKaI和pK2,求HS的pKb。 解 HS+Ht亡H2S pKR=pKw-pKa1=14.00-6.88=7.12 KaKb2 Ka2Kb1 K 山东理工大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry
Analytical Chemistry 7 例1: H3PO4水溶液中的共轭酸碱对及其酸碱强度关系 如何? K K K K K K K a b a b a b w 1 3 2 2 3 1 例2:已知H2S的pKa1和pKa2,求HS-的pKb 。 解 HS + H + H2 S p p - p 14 .00 6.88 7.12 2 w 1 b a K K K K K K K K a b a b w 1 2 2 1 Ka Kb= Kw 一种酸的酸性越强,其共轭碱的碱性越弱

42 酸碱溶液中的分布分数 分析浓度和平衡浓度 对一元弱酸: HAH+AK=HJA [HA] 平衡浓度:HA,[A] 分析浓度:酸的总浓度c c=[HA]+[A] HA,[A]随pH的变化而变化 酸的总浓度c不随pH变化 山东覆王大军 HANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 8
Analytical Chemistry 8 酸碱溶液中的分布分数 分析浓度和平衡浓度 对一元弱酸: [H ][A ] H A H A [H A] K a 分析浓度:酸的总浓度c 平衡浓度:[HA], [A- ] c [HA] [A ] [HA], [A- ]随pH的变化而变化 酸的总浓度c不随pH变化