
第5章配位滴定法 5.1概述 5.2 EDTA与金属离子的配合物及其稳定性 5.3外界条件对EDTA与金属离子配合物稳定性的影响 5.4配位滴定曲线 5.5金属指示剂确定滴定终点的方法 5.7配位滴定的方式和应用
1 5.1 概述 5.2 EDTA与金属离子的配合物及其稳定性 5.3 外界条件对EDTA与金属离子配合物稳定性的影响 5.4 配位滴定曲线 5.5 金属指示剂确定滴定终点的方法 5.7 配位滴定的方式和应用 第5章 配位滴定法

5.4 滴定曲线 配位滴定曲线 pM12 M+Y'≌MY' 10 8 6 4 pM=-1g[M'] 0 0 50 100 150 200 随标准溶液(EDTA)的不断加入,溶液的M'I即 滴定百分数% pM'=-gMI不断变化,到化学计量点时产生突 跃,与酸碱滴定一样绘制曲线。 配位滴定曲线:溶液p'随滴定分数a变化的曲线。 山东理工大军 HANDONGUNIVERSITYOF TECHNOLOGY Analytical Chemistry 2
Analytical Chemistry 2 pM' lg[M'] M Y MY 滴定曲线 配位滴定曲线 配位滴定曲线:溶液pM随滴定分数a变化的曲线。 0 2 4 6 8 10 12 0 50 100 150 200 滴定百分数% pM' 随标准溶液(EDTA) 的不断加入,溶液的[M]即 pM= - lg[M]不断变化,到化学计量点时产生突 跃,与酸碱滴定一样绘制曲线

I例]pH=9.0,0.01000mol/L的EDTA滴定20.00mL, 0.01000mol/L的Zn2+(IgKzny-16.5,pH=9.0,lgy0m=1.28, Igazn(OH)-0.2) [解] IgK'zny =1g KznY-Igazn-lgay =15.02 1、滴定前 pZn'=-1g[Zn']=-1gCzn =2.00 2、sp前Zl=a-=0.1%c8 p Zn 7n Vzn +Vy 加入19.98 ml EDTA pZn'=5.30 上本理工大客 Analytical Chemistry 3
Analytical Chemistry 3 [例] pH=9.0,0.01000mol/L的EDTA滴定20.00mL, 0.01000mol/L的Zn2+( lgKZnY=16.5, pH=9.0, lgαY(H)=1.28, lgαZn(OH)=0.2 ) [解] lgK' ZnY lgKZnY lgZn lgY 15.02 1、滴定前 pZn' lg[Zn'] lgCZn 2.00 2、sp前 Zn Zn Y sp Zn Zn Y ( ) [Zn'] 0.1% c V V c V V 加入19.98ml EDTA pZn =5.30 sp Zn Zn 2 c c

3、sp时 KZnY ZnY1sp-=10l5.02 [Zn'Isp[Y Isp [ZnY"lp≈c [Zn']sp =[Y']sp 注: 2= 2 c叨 [Zn'Isp=1K'ZnY pZn'-(8Kzay +po)6.40 4、Sp后 小 [ZnY'] [ZnY]≈c y=-)=0,1%c Vin +Vy 加入20.02 ml EDTA pZn'=12.02 山东理工大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry
Analytical Chemistry 4 3、sp时 15.02 sp sp ' sp ZnY 10 [Zn'] [Y' ] [ZnY' ] K (lg ' p ) 6.40 2 1 pZn ' sp sp ZnY Zn K c sp sp Zn [ZnY'] c sp sp [Zn'] [Y'] ZnY sp sp ' [Zn'] Zn K c 注: 4、sp后 ' [Y' ] [ZnY' ] [Zn'] K ZnY 加入20.02ml EDTA sp Zn [ZnY'] c pZn =12. 02 Zn Y Zn sp Zn Zn Y ( ) [Y'] 0.1% c V V c V V sp Zn Zn 2 c c
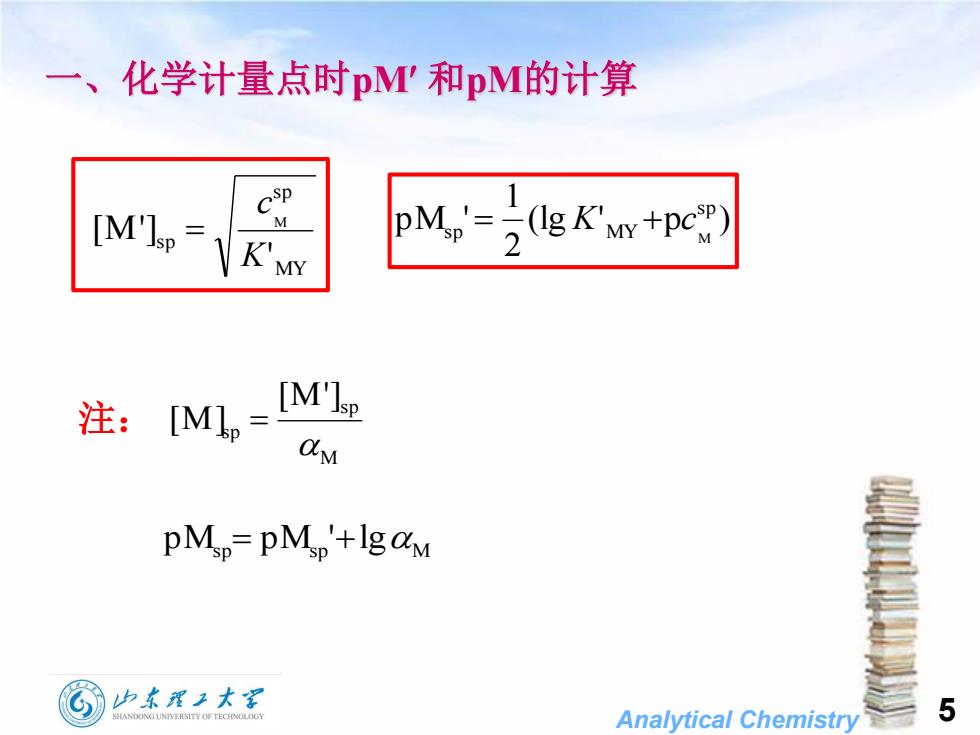
一、 化学计量点时p'和pM的计算 [M'lsp= M K'MY pM('+pe 注:M,=M PMp=PMp+Ig&M 山东覆王大军 Analytical Chemistry 5
Analytical Chemistry 5 一、化学计量点时pM 和pM的计算 (lg ' p ) 2 1 p M ' sp sp MY M K c MY sp sp ' [M '] M K c 注: M sp sp [M '] [M ] p Msp p Msp 'lg M