
4.1.3 喀度积靓则 AB(S) nAmt(aq)+mBn-(aq) KB={c(A*)}"{c(B)}m 在一定温度下,难溶电解质溶液,其离 子浓度的乘积称为离子积,用符号J表示。 J={c(A)}{c(B-)}m 某一难溶电解质在一定条件,沉淀能否 生成或溶解,可以根据溶度积与离子积的关 系即溶度积规则来判断
AnBm(s) nAm+ (aq)+mBn- (aq) 在一定温度下,难溶电解质溶液,其离 子浓度的乘积称为离子积,用符号J表示。 4.1.3 溶度积规则 Ksp ={c(Am+ )}n {c(Bn- )}m J ={c(Am+ )}n {c(Bn- )}m 某一难溶电解质在一定条件,沉淀能否 生成或溶解,可以根据溶度积与离子积的关 系即溶度积规则来判断

4.1.3 喀度积规则 (1)当>K时,为过饱和溶液,有沉淀析 出,直至饱和。 (2)当J=K9时,为饱和溶液,达平衡状态。 即不生成沉淀,沉淀也不溶解。 (3)当J<K时,为不饱和溶液,无沉淀析 出,若体系中尚有沉淀存在,沉淀将会溶解, 直至饱和
(3)当J< 时,为不饱和溶液,无沉淀析 出,若体系中尚有沉淀存在,沉淀将会溶解, 直至饱和。 Ksp (2)当J= 时,为饱和溶液,达平衡状态。 即不生成沉淀,沉淀也不溶解。 Ksp 4.1.3 溶度积规则 (1)当J> 时,为过饱和溶液,有沉淀析 出,直至饱和。 Ksp

4.1.3 喀度积靓则 例:在等体积混合0.002moL1的Na,S04溶 液和0.02moL1的BaCL,溶液,是否有白色 的BaSO沉淀生成?是否沉淀完全?[已知K (BaS04)=1.1X10-10]
4.1.3 溶度积规则 例:在等体积混合0.002 mol·L-1的Na2 SO4溶 液和0.02 mol·L-1的BaCl2溶液,是否有白色 的BaSO4沉淀生成?是否沉淀完全?[已知Ksp (BaSO4)=1.1×10-10]
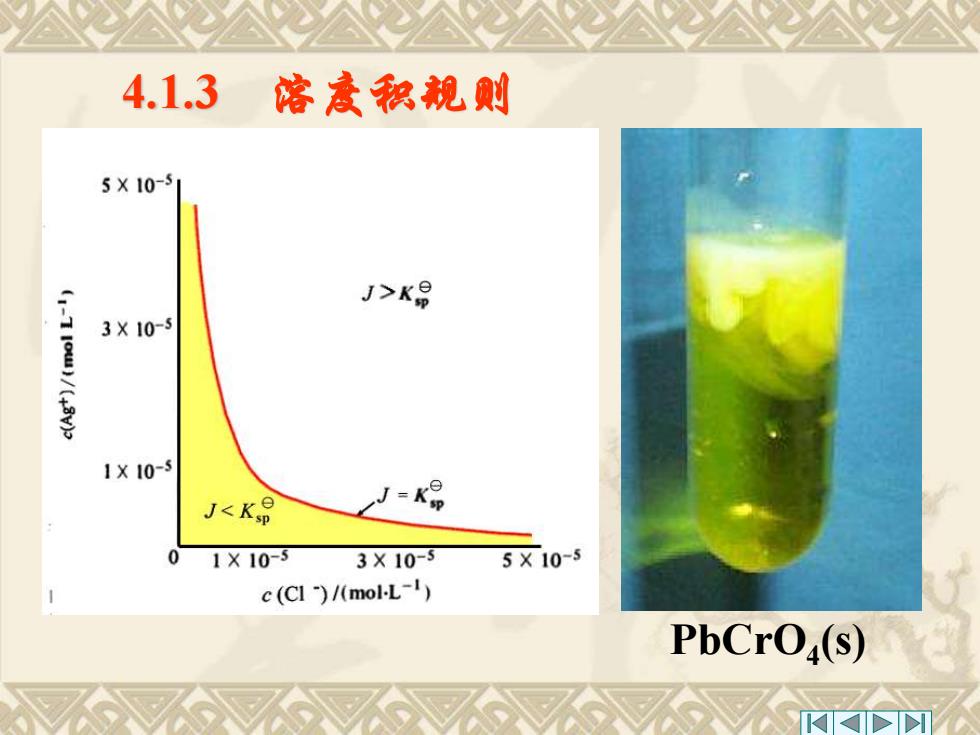
4.1.3 喀度积规则 5X10-5 j>K 3X10-5 1X10-5 J<K0 0 1X10-3 3X10-3 5X10-5 c (CI )/(mol-L-I) PbCrO(s)
PbCrO4 (s) 4.1.3 溶度积规则

4.1.3 喀意积靓则 例:某温度下Mg(OH)2的s=6.53×10-3gL 1(1)若在100mL0.1moL-1的MgCl2溶液 中加入100mL0.1molL-1的NH3H20有无↓ 产生? (2)若产生可加多少NH,C才不产生↓ 在牙析花学上,一般把经过沉淀后,溶液 中残溜的离子浓度小于1×105moL1,即认 为沉淀完全
例:某温度下Mg(OH)2的s=6.53×10-3g·L - 1(1)若在100mL0.1mol·L -1的MgCl2溶液 中加入100mL0.1mol·L -1的NH3H2O有无↓ 产生? (2)若产生↓可加多少NH4Cl才不产生↓ 在分析化学上,一般把经过沉淀后,溶液 中残留的离子浓度小于1×10-5 mol·L-1,即认 为沉淀完全 。 4.1.3 溶度积规则