
第七章沉淀滴定法 ★( Precipitation Titrations
1 第七章 沉淀滴定法 (Precipitation Titrations)

7.1 概述 ·滴定原理: 用沉淀反应来进行滴定分析的方法 ·滴定条件: >沉淀有固定的组成,反应物之间有准确的计量关系 >; 沉淀溶解度小,反应完全 >沉淀吸附杂质少 >反应速度快,有合适的指示终点的方法 ·分析方法-银量法: 》莫尔法 》佛尔哈德法 >法扬司法 Analytical Chemistry 2
Analytical Chemistry 2 概 述 • 滴定原理: 用沉淀反应来进行滴定分析的方法 • 滴定条件: ➢ 沉淀有固定的组成,反应物之间有准确的计量关系 ➢ 沉淀溶解度小,反应完全 ➢ 沉淀吸附杂质少 ➢ 反应速度快,有合适的指示终点的方法 • 分析方法-银量法: ➢ 莫尔法 ➢ 佛尔哈德法 ➢ 法扬司法 概 述

72 确定终点的方法 0.1000moL1AgN03滴定20.0ml0.1000 mol L-INaC1溶液 Ag++CI=AgCI Kp=[Ag][C]=1.8X10-10 PAg+pCl-pKsD K=(Kp)1=(1.8×10-10)1=5.6×109 化学计量点:[Ag]=[C] [Ag*][CI-]=Ksp [Ag'lsp=Ksp=10-47 pCIsp=pAgsp =4.7 g 加东理2大深 Analytical Chemistry 3
Analytical Chemistry 3 Ag+ + Cl- = AgCl↓ Ksp= [Ag+ ][Cl- ]=1.8×10-10 pAg+pCl=pKsp K=(Ksp) -1= (1.8×10-10 ) -1 = 5.6×109 0.1000 mol·L-1 AgNO3滴定20.0 ml 0.1000mol·L-1NaCl 溶液 化学计量点:[Ag+ ]=[Cl- ] pCl pAg 4.7 [Ag ] 10 s p s p 4.7 s p s p = = = = + − [Ag ][Cl ] = Ksp K + − 确定终点的方法
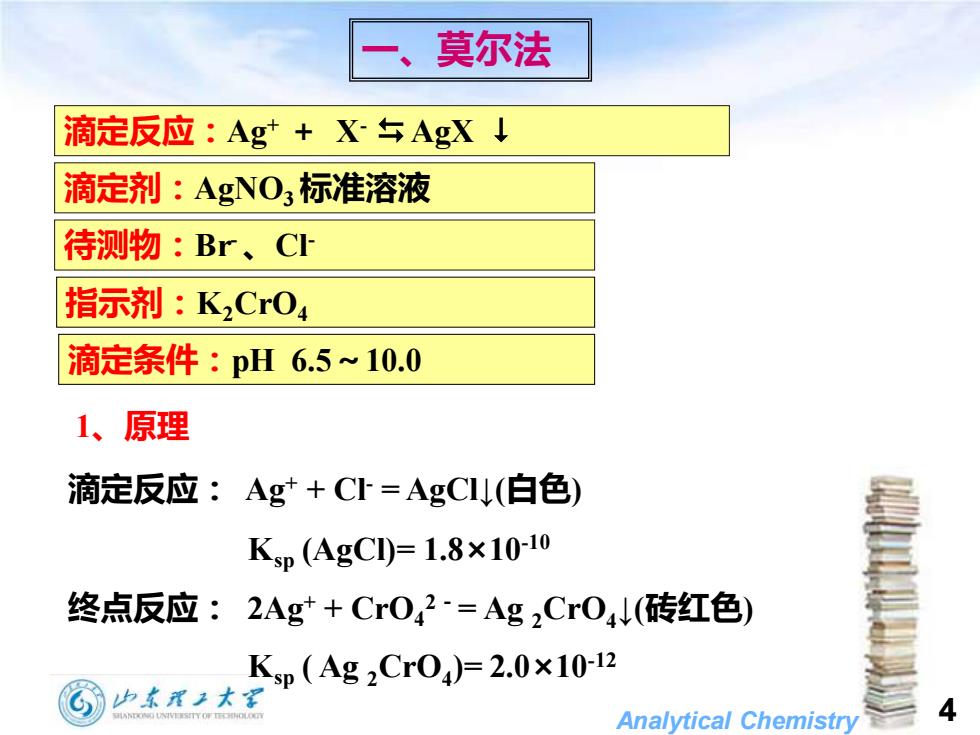
莫尔法 滴定反应:Ag+X与AgX↓ 滴定剂:AgNO3标准溶液 待测物:Br、C 指示剂:K2CrO4 滴定条件:pH6.5~10.0 1、原理 滴定反应:Ag+C=AgCU(白色) Ksp(AgCI)=1.8×10-10 终点反应:2Ag*+Cr042=Ag2Cr04(砖红色) Ksp(Ag2Cr04)=2.0×10-12 血本理2大 Analytical Chemistry
Analytical Chemistry 4 滴定反应: Ag+ + Cl- = AgCl↓(白色) Ksp (AgCl)= 1.8×10-10 终点反应: 2Ag+ + CrO4 2-= Ag 2CrO4 ↓(砖红色) Ksp ( Ag 2CrO4 )= 2.0×10-12 一、莫尔法 指示剂:K2CrO4 滴定反应:Ag+ + X- AgX 滴定剂:AgNO3 标准溶液 待测物:Br-、Cl- 滴定条件:pH 6.5~10.0 1、原理

2、滴定条件 (1)指示剂的用量 化学计量点时:[Ag1p=[Cr]p=VKp(AgC=V1.8×100=1.3×10 形成Ag2CrO4所需的最低的Cr042]: [Ag'T[CrO 1=Ks(Ag2CrO) 则 IC0n-KnAg,C0,)。20×10 [Ag"P (1.3x10p=1.2×102 K,CrO,浓度 理论值1.2×10-2moL1 实验值 5×103moL1为宜 Cr042太大,终点提前,Cr04黄色干扰 C042太小,终点滞后 5
Analytical Chemistry 5 2、滴定条件 -10 -5 s p - [Ag ] =[Cl ] = (AgCl) = 1.810 =1.310 + s p s p K [Ag ] [CrO ] (Ag CrO ) sp 2 4 2- 4 2 sp sp = K + -2 -5 2 -12 2 2- s p 2 4 4 1.2 10 (1.3 10 ) 2.0 10 [Ag ] (Ag CrO ) [CrO ] = = = + K 则 s p 形成Ag 2CrO4所需的最低的[CrO4 2- ]: (1)指示剂的用量 化学计量点时: K2CrO4浓度 理论值 1.2×10-2 mol·L-1 实验值 5×10-3 mol·L-1为宜 CrO4 2-太大,终点提前, CrO4 2-黄色干扰 CrO4 2-太小,终点滞后