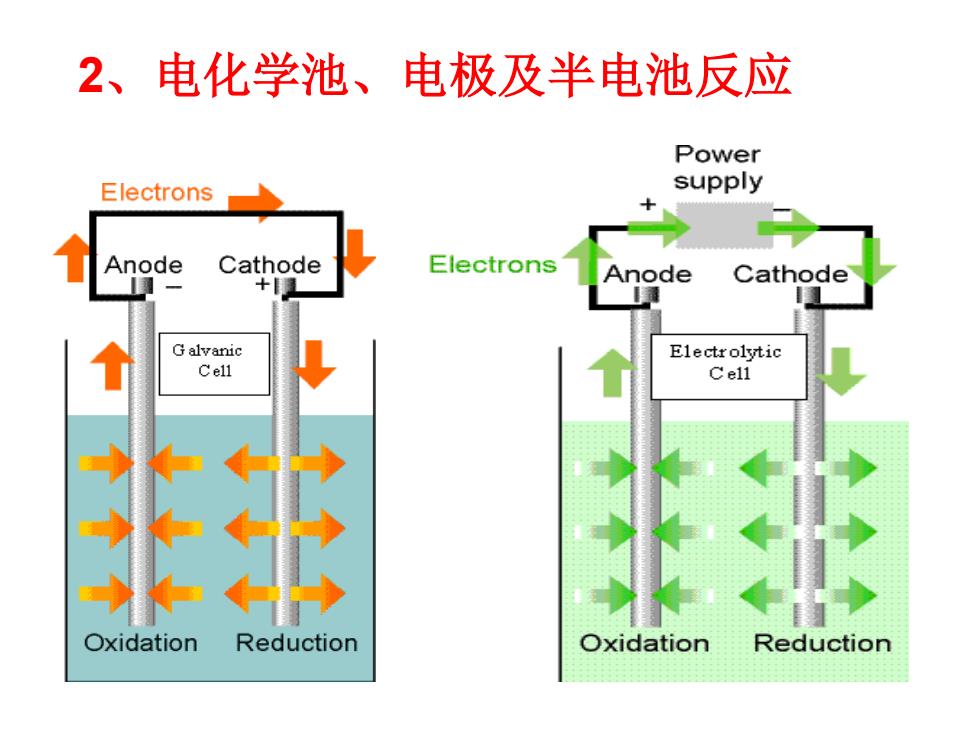
2、电化学池、电极及半电池反应 Power Electrons supply Anode Cathode Electrons Anode Cathode G alvanic Electrolytic Cell Cel1 Oxidation Reduction Oxidation I Reduction
2、电化学池、电极及半电池反应

问题1:阳极与阴极;正极与负极 在电解池与原电池中的对应关系是怎样的? 问题2: 请说出铅酸蓄电池的在充电和放电时;两 个电极(Pb及Pb02)分别是什么极
问题1: 阳极与 阴极;正极与 负极 在电解池与原电池中的对应关系是怎样的? 问题2: 请说出铅酸蓄电池的在充电和放电时;两 个电极(Pb及PbO2)分别是什么极

二、Faraday电解定律 1.文字表述: 通电于电解质溶液之后 ()在电极上发生化学变化的物质的量与通入的电量成 正比; (2)若将几个电解池串联,在各个电解池的电极上发生 反应的物质的量相等
二、 Faraday 电解定律 1. 文字表述: 通电于电解质溶液之后 (1) 在电极上发生化学变化的物质的量与通入的电量成 正比; (2) 若将几个电解池串联,在各个电解池的电极上发生 反应的物质的量相等

2.数学表达式: (1)法拉第常数(F:1mol元电荷的电荷量。用F表示 F=Le=6.022×1023×1.6022×10-19 =96485/Cmol-≈96500/Cmo-1 (2)数学表达式 电解池中阴极上发生如下还原反应 M++Z+e→M 则通入电荷量Q时, 沉积的金属M的物质的量为 n=Q/z+F
2. 数学表达式: (1)法拉第常数(F):1mol元电荷的电荷量。用F表示 F = L·e = 6.022×1023×1.6022×10-19 = 96485 / C·mol-1≈ 96500 / C·mol-1 Mz+ + z+ e - →M (2) 数学表达式 电解池中阴极上发生如下还原反应 则 通入电荷量Q时, 沉积的金属M的物质的量为 n = Q/ z+F

3.应用: (1)原子量的测定 (2)库仑计和库伦分析上的应用 (3)电解与电沉积行业的应用 4.意义: (1)是电化学上的定量基本定律。揭示了通入 的电量与析出的物质的量的定量关系。 (2)实际生产中,计算电流效率
3. 应用: (1)原子量的测定 (2)库仑计和库伦分析上的应用 (3)电解与电沉积行业的应用 4. 意义: (1)是电化学上的定量基本定律。揭示了通入 的电量与析出的物质的量的定量关系。 (2)实际生产中,计算电流效率