
后酒子大学 Shihezi University 0.0s92则 YIRed Cox (ao为OX的副反应系数),则[Or]= dox p=°+0.0592, Yox' 00s YRed" C Red 0=p9+ C匹 .005921gYo.gau4+0.0592 g n YRed'Qa n CRed
O x Ox O x Ox O x C OX Ox Ox C α α = (α ), [ ] = [ ] 为 的副反应系数 则 [Re ] [ ] lg 0.0592 d Ox n R O γ γ ϕ ϕθ = + Red d d Ox Ox O C C n X α γ α γ ϕ ϕθ Re Re lg 0.0592 ⋅ ⋅ = + d ox d Ox O d C X C Re Re Re lg n 0.00592 lg n 0.00592 + ⋅ ⋅ = + γ α γ α ϕ ϕθ

酒节大 Shihezi University 0.00592 0.00592 C p=p9+ g Yox'ORed n YRed'aar n 0.00592 YoxORed P=0+ 0.00592 ar n YRedaax n ■条件电极电位的意义:是在一定介质条件下,氧化态和还 原态的总浓度均为1moL时,校正了各种因素影响后电对的 实际电极电位,在一定条件下为一常数。它反映了在外界因 素影响下,氧化还原电对的实际氧化还原能力。 ■应用条件电位比用标准电极电位能更正确地判断氧化还原 反应的方向、次序和反应完成的程度
d Ox OX d γ α γ α ϕ ϕ θ θ ⋅ ⋅ = + Re ' Re lg n 0.00592 d ox C C Re 0 lg n 0.00592 ϕ = ϕ '+ � 条件电极电位的意义: 条件电极电位的意义: 是在一定介质条件下,氧化态和还 是在一定介质条件下,氧化态和还 原态的总浓度均为 原态的总浓度均为1 mol·L-1-1时,校正了各种因素影响后 校正了各种因素影响后电对的 实际电极电位,在一定条件下为一常数。它 ,在一定条件下为一常数。它反映了在外界因 反映了在外界因 素影响下,氧化还原电对的实际氧化还原能力 素影响下,氧化还原电对的实际氧化还原能力。 � 应用条件电位比用标准电极电位能更正确地判断氧化还原 应用条件电位比用标准电极电位能更正确地判断氧化还原 反应的方向、次序和反应完成的程度。 反应的方向、次序和反应完成的程度。 d ox d Ox O d C X C Re Re Re lg n 0.00592 lg n 0.00592 + ⋅ ⋅ = + γ α γ α ϕ ϕθ

后调节大学 Shihezi University 口由于实际体系的反应条件多种多样,条件电位的数据目前还 很有限; 口在缺乏相同条件下的条件电位时,可采用条件相近的条件电 位数据。例如,未查到1.5 mol-L-H2S04溶液中Fe3+Fe2+电对的 条件电位,可用1.0moL1H2S04溶液中的条件电位(0.68V) 代替。若采用标准电极电位(0.77V),误差更大
�由于实际体系的反应条件多种多样,条件电位的数据目前还 由于实际体系的反应条件多种多样,条件电位的数据目前还 很有限; �在缺乏相同条件下的条件电位时,可采用条件相近的条件电 在缺乏相同条件下的条件电位时,可采用条件相近的条件电 位数据。例如,未查到 位数据。例如,未查到1.5 mol 1.5 mol 1.5 mol 1.5 mol 1.5 mol 1.5 mol 1.5 mol 1.5 mol·L-1-1H22SO44溶液中Fe3+3+ /Fe2+2+电对的 条件电位,可用 条件电位,可用1.0 mol 1.0 mol 1.0 mol 1.0 mol 1.0 mol 1.0 mol 1.0 mol 1.0 mol·L-1-1 H22SO44溶液中的条件电位( 溶液中的条件电位(0.68V) 代替。若采用标准电极电位( 代替。若采用标准电极电位(0.77V),误差更大。 ),误差更大

后酒子大 Shihezi University 例:计算0.5 mol-L-HS0,溶液中 cce+=1.00×10-3molL ce=1.00×102mol.L 时Ce+/Ce+电对的电极电位。 解在0.5 mol-L-HS0介质中, ce"ice =1.44V 0e7c=980e+0.059V1ge=1.44V+0.059V1g .00×10-3 Cce .00×10-2 =1.38V
4 3 -1 Ce c . + 1 00 10 mol L − = × ⋅ 3 2 -1 Ce c . + 1 00 10 mol L − = × ⋅ 4+ 3+ θ Ce /Ce ϕ =1 44V . ˊ 4 4 3 4+ 3+ 3 3 θ Ce Ce Ce Ce /Ce 2 Ce 1 00 10 0 059Vlg 1 44V 0 059Vlg 1 00 10 1 38V / c . . . . c . . ϕ ϕ + + + + − − × = + = + × = ˊ 例: 计算0.5 mol 0.5 mol 0.5 mol 0.5 mol 0.5 mol 0.5 mol 0.5 mol 0.5 mol·L-1-1H22SO44溶液中 , 时Ce4+4+ /Ce3+3+电对的电极电位。 电对的电极电位。 解 在0.5 mol 0.5 mol 0.5 mol 0.5 mol 0.5 mol 0.5 mol 0.5 mol 0.5 mol·L-1-1H22SO44介质中
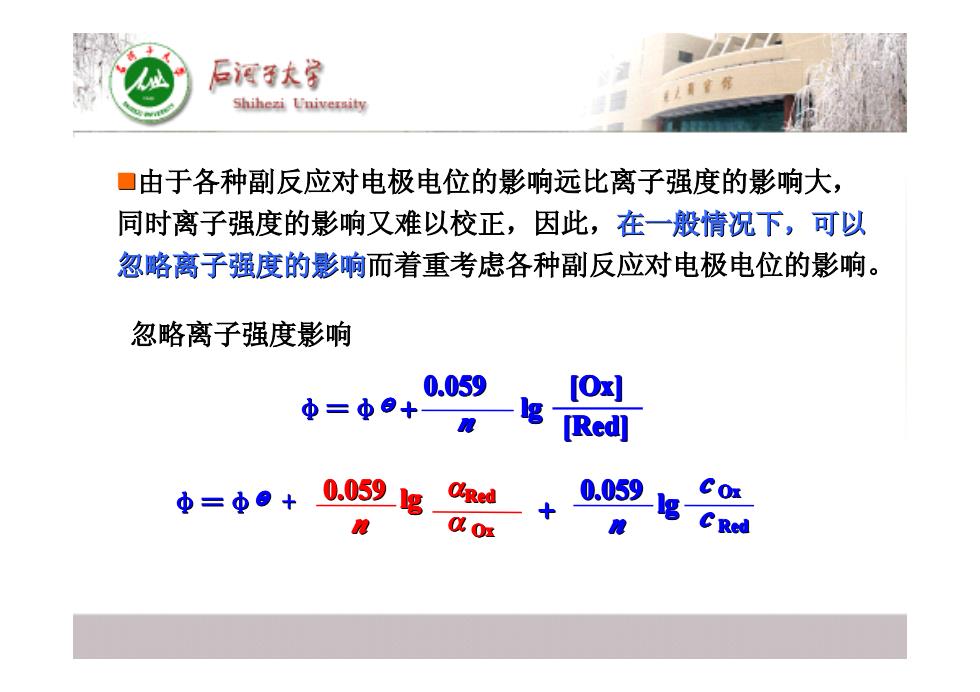
后酒子大学 Shihezi University ■由于各种副反应对电极电位的影响远比离子强度的影响大, 同时离子强度的影响又难以校正,因此,在一般情视下,可以 忽略离子强度的影响而着重考虑各种副反应对电极电位的影响。 忽略离子强度影响 0.059 [Ox] 中=中9+ [Red] 中=中o+.059g+ 0.059 &0r
�由于各种副反应对电极电位的影响远比离子强度的影响大, 由于各种副反应对电极电位的影响远比离子强度的影响大, 同时离子强度的影响又难以校正,因此, 同时离子强度的影响又难以校正,因此,在一般情况下,可以 在一般情况下,可以 忽略离子强度的影响 忽略离子强度的影响而着重考虑各种副反应对电极电位的影响。 而着重考虑各种副反应对电极电位的影响。 忽略离子强度影响 忽略离子强度影响 0.059 0.059 lg n c Ox Ox n φ=φӨӨ + + lg αRed Red α Ox Ox c Red Red 0.059 lg [Ox] φ n =φӨӨ + [Red]