
石河子大学化学化工学院分析化学教案 授误 内容 第五章酸碱滴定法 课时安排10学时 进一步理解酸碱质子理论中酸碱的定义、共轭酸碱对、酸碱反应的实质以及溶剂的质子自递反 等基本概念: 教学 2堂据酸碱平衡体系中冬型体分有分粉的计算和用质子理论处理酸碱平商: 3.掌握几种常用缓冲溶液的配制方法、pH值的计算以及缓冲容量,缓冲范围的概念 4了解酸碱指示剂的变色原理、变色范围: 5.理解各种类型酸碱滴定过程中pH值的变化规律,掌提正确选择指示剂的方法: 6.掌挥酸碱滴定分析有关计算, 教学 重点 重点:用质子理论处理酸碱平衡:指示剂的选择:突跃范用:有关计算。 难点 难点:用质子理论处理酸碱平衡。 教学 方法 讲授为主,启发式和互动式相结合 手段 多媒体教学为主,传统教学为辅。 酸碱历子理论 2酸碱反应 3.溶剂的质子自递反应和溶剂的种类 酸碱的强度与溶剂的关系 :、水溶液中弱酸(碱)各型体的分布 1几.个每今: 2.处理水溶液中酸碱平衡的方法:3.酸度对弱酸(碱)各型体分布的影吧 、酸碱溶液中氯离子浓度的计算 1.一元强酸、强碱溶液中浓度的计算:2.一元弱酸弱碱溶液 子4 3.多元弱酸(碱》溶液H门的计算 4.两性物质溶液酸度的计算:5.混合酸溶液。 四、酸碱缓冲溶液 内 1.缓冲溶液pH值的计算:2.缓冲容量和缓冲范围:3.缓冲溶液的选择和配制 五、酸碱指示剂 容 L酸指示剂的变色限理 2,指示剂的变色pH范围 3.使用酸碱指示剂需注意的问题 4.混合指示剂。 六、强酸(碱)和一元弱酸(碱)的滴定 1.强酸与强碱的滴定:2.强碱(酸)滴定一元夠酸(碱): 3.直接准确商定一元弱酸(碱)的可行性判据:4.终点误差 化、多元酸碱的演定 L.多元酸(碱)分步滴定的可行性判据: 2.多元酸的滴定 .多元碱的滴定:4.混合酸(碱)的滴定:5.酸碱滴定中C0,的形响 八、酸碱滴定法的应用 1海合能的分析,2被盐中含氨量的测定,3某此有机化合物含量的定 4.极弱酸(碱)的滴定:5.某些无机物含量的测定:6.非水溶液中酸碱滴定。 课外学 根据本章要求,查阅相关资料,并上课程网复习巩周,完成相应作业 习要求 教学 后记
石河子大学化学化工学院-分析化学教案 2 授课 内容 第五章 酸碱滴定法 课时安排 10 学时 教学 目的 要求 1. 进一步理解酸碱质子理论中酸碱的定义、共轭酸碱对、酸碱反应的实质以及溶剂的质子自递反应 等基本概念; 2. 掌握酸碱平衡体系中各型体分布分数的计算和用质子理论处理酸碱平衡; 3. 掌握几种常用缓冲溶液的配制方法、pH 值的计算以及缓冲容量,缓冲范围的概念; 4. 了解酸碱指示剂的变色原理、变色范围; 5. 理解各种类型酸碱滴定过程中 pH 值的变化规律,掌握正确选择指示剂的方法; 6. 掌握酸碱滴定分析有关计算。 教学 重点 难点 重点:用质子理论处理酸碱平衡;指示剂的选择;突跃范围;有关计算。 难点:用质子理论处理酸碱平衡。 教学 方法 手段 讲授为主,启发式和互动式相结合; 多媒体教学为主,传统教学为辅。 学 内 容 提 纲 一、酸碱质子理论 1. 基本概念; 2. 酸碱反应; 3. 溶剂的质子自递反应和溶剂的种类; 4. 酸碱的强度与溶剂的关系。 二、水溶液中弱酸(碱)各型体的分布 1. 几个概念; 2. 处理水溶液中酸碱平衡的方法; 3. 酸度对弱酸(碱)各型体分布的影响。 三、酸碱溶液中氢离子浓度的计算 1. 一元强酸、强碱溶液中 H +浓度的计算; 2. 一元弱酸弱碱溶液; 3. 多元弱酸(碱)溶液[H+ ]的计算; 4. 两性物质溶液酸度的计算; 5. 混合酸溶液。 四、酸碱缓冲溶液 1. 缓冲溶液 pH 值的计算; 2. 缓冲容量和缓冲范围; 3. 缓冲溶液的选择和配制 五、酸碱指示剂 1. 酸碱指示剂的变色原理; 2. 指示剂的变色 pH 范围 3. 使用酸碱指示剂需注意的问题; 4. 混合指示剂。 六、强酸(碱)和一元弱酸(碱)的滴定 1. 强酸与强碱的滴定; 2. 强碱(酸)滴定一元弱酸(碱); 3. 直接准确滴定一元弱酸(碱)的可行性判据; 4. 终点误差。 七、多元酸碱的滴定 1. 多元酸(碱)分步滴定的可行性判据; 2. 多元酸的滴定; 3. 多元碱的滴定; 4. 混合酸(碱)的滴定; 5. 酸碱滴定中 CO2 的影响。 八、酸碱滴定法的应用 1. 混合碱的分析; 2. 铵盐中含氮量的测定; 3. 某些有机化合物含量的测定; 4. 极弱酸(碱)的滴定;5. 某些无机物含量的测定;6. 非水溶液中酸碱滴定。 课外学 习要求 根据本章要求,查阅相关资料,并上课程网复习巩固,完成相应作业。 教学 后记

石河子大学化学化工学院分析化学教案 第五章酸碱滴定法 进程: §41酸碱质子理论 一、基本概念 酸碱质子理论(由布朗斯特(Br中s时dJN)于1923年提出)对酸碱的定义是:一切能放出质子(H 的物质就是酸,能接受质子(什)的物质就是碱。 二、酸碱反应 酸碱反应的实质是两个共轭酸碱对之间的质子传递反应。酸碱质子理论不仅把酸与碱的关系统一在质 子上,而且把酸与碱的反应统一在质子的传递上。 1.酸碱的相对性 2共钯的绝对性 3.广泛性 三、溶剂的质子自递反应和溶剂的种类 以HO为例: H20+H20 H,0+OH 象这种仅在溶剂分子之间发生的质子传递作用,就叫做溶剂的质子自递反应。反应的平衡常数就叫做 溶剂的质子自递常数(用Ks表示)或称溶剂的离子积。 O的离子积是用Kw表示的。即 [H][OH=Kw=1.0×104 (25℃】 pKw=14.00 又如:有机溶剂甲醇,它有与0相似的离解平衡,生成溶剂化质子: [CHOH]+HCHO]=K=2.0×1017 pKs=16.70 根据酸碱质子理论,溶剂可分为以下四类 ①碱性溶剂:接受质 能力较强的溶剂 又叫亲质子溶剂。 ②酸性溶剂:给出质子能力较强的溶剂,又叫疏质子溶剂。 ③两性溶剂:既能给出质子又能接受质子的溶剂。 ④惰性溶剂:既不给出质子,又不接受质子的溶剂。 四、酸碱的强度与溶剂的关系 酸碱的 弱与酸 的性质及溶剂的性质有关(无机已讨论 日共酸碱对的K和K的关系(无机已讲,略) 652水落液中弱酸(碱)各型体的分布 几个念 1.分析浓度和平衡浓度 分析浓度:就是单位体积溶液中所含溶质的物质的量,就是分析浓度(即物质的量浓度)。用C表示。 单位为molL或mol/dm或mmol/L。分析浓度也叫标签浓度或总浓度。 平衡浓度:指平衡状态时,溶液中存在的各种型体的浓度,就是平衡浓度。用“”表示
石河子大学化学化工学院-分析化学教案 3 第五章 酸碱滴定法 进程: §4-1 酸碱质子理论 一、基本概念 酸碱质子理论(由布朗斯特(Brφnsted J N)于 1923 年提出)对酸碱的定义是:一切能放出质子(H+) 的物质就是酸,能接受质子(H+)的物质就是碱。 二、酸碱反应 酸碱反应的实质是两个共轭酸碱对之间的质子传递反应。酸碱质子理论不仅把酸与碱的关系统一在质 子上,而且把酸与碱的反应统一在质子的传递上。 1. 酸碱的相对性 2. 共轭的绝对性 3. 广泛性 三、溶剂的质子自递反应和溶剂的种类 以 H2O 为例: H2O+H2O H3O+ + OH- 象这种仅在溶剂分子之间发生的质子传递作用,就叫做溶剂的质子自递反应。反应的平衡常数就叫做 溶剂的质子自递常数(用 KS表示)或称溶剂的离子积。 H2O 的离子积是用 KW 表示的。即 [H+ ][OH- ] = KW = 1.0×10-14 (25℃) pKW=14.00 又如:有机溶剂甲醇,它有与 H2O 相似的离解平衡,生成溶剂化质子: [CH3OH2]+[CH3O- ] = Ks = 2.0×10-17 pKS=16.70 根据酸碱质子理论,溶剂可分为以下四类: ①碱性溶剂:接受质子能力较强的溶剂,又叫亲质子溶剂。 ②酸性溶剂:给出质子能力较强的溶剂,又叫疏质子溶剂。 ③两性溶剂:既能给出质子又能接受质子的溶剂。 ④惰性溶剂:既不给出质子,又不接受质子的溶剂。 四、酸碱的强度与溶剂的关系 ㈠ 酸碱的强弱与酸碱的性质及溶剂的性质有关(无机已讨论) ㈡ 共轭酸碱对的 Ka和 Kb 的关系(无机已讲,略) §5~2 水溶液中弱酸(碱)各型体的分布 一、几个概念 1. 分析浓度和平衡浓度 分析浓度:就是单位体积溶液中所含溶质的物质的量,就是分析浓度(即物质的量浓度)。用 C 表示。 单位为 mol/L 或 mol/dm3 或 mmol/L。分析浓度也叫标签浓度或总浓度。 平衡浓度:指平衡状态时,溶液中存在的各种型体的浓度,就是平衡浓度。用“[]”表示

石河子大学化学化工学院分析化学教案 2.酸的浓度和酸度 酸度:是指溶液中H的浓度(严格说来是甲的活度),常用H表示。 酸的浓度:就是酸的分析浓度,即物质的量浓度, 二、处理水溶液中酸碱平衡的方法 质子条件:在酸碱反应中,质子转移的平衡关系就叫做质子条件或质子平衡,它的数学表达式叫质子 等衡式,用PBE表示。 (口由物料平衡和电荷平衡方程导出质子条件 1物料平街(MBE) 物料平衡就是指在 一个化学平衡体系中,某一给定组分的分析浓度(即总浓度)等于溶质各型体(即 各有关组分)平衡浓度的总和。物料平衡又叫质量平衡,用MBE表示。它的数学表达式叫做质量等衡式 或物料等衡式。也就是前面的分析浓度与平衡浓度间的关系式。 例1:写出浓度为Cmol/L的NaHCO溶液的物料等衡式。 解:(见课件) 例2:写出浓度为Cmol/L.的NaS0,溶液的物料等衡式。 解:(见课件)) MBE练习: 1:Cmol/mL的HAC的物料平衡式 C=[HACI+[AC-] 2:Cmol/mL的H,PO,的物料平衡式 C=[HPO]+[H2PO:]+[HPO]+[PO4] 3:Cmol/mL的Na:HPO.4的物料平衡式 INa']=2C C=[]+[H:POr]+[HPO]+[PO] 4: C mol/mL的NaHCO的物料平衡式 [Na']=C C=HC0]+HC0]+[C02 2.电荷平衡(CBE)(四师P91) 根据电中性的原则,单位体积中总的正电荷数等于总的负电荷数。或者说,反应处于平衡状态时,溶 液中正电荷的总浓度必等于负电荷的总浓度。这一规律称为电荷平衡,它的数学表达式叫做电荷等衡式或 电荷平衡方程,用CBE表示。 例1:(见课件) 例2:(见课件)》 例3:(见课件)》 CBE练习:(见课件) 3.由MBE和CBE导出PBE(举例说明) 1:(见课件) 例2: 米件。 口由酸碱平衡体系中,得、失质子的物质的量应相等的原则直接导出质子条件 采用这种方法,首先必须选择合适的零水准物质,然后把由水准状态转变为获得质子的组分所得质子 的浓度之和列在等式的左边,把从水准状态转变为失去质子的各种组分所失去质子的浓度之和列在等式的 右边,这样的平衡关系就是质子条件
石河子大学化学化工学院-分析化学教案 4 2. 酸的浓度和酸度 酸度:是指溶液中 H+的浓度(严格说来是 H+的活度),常用 pH 表示。 酸的浓度:就是酸的分析浓度,即物质的量浓度。 二、处理水溶液中酸碱平衡的方法 质子条件:在酸碱反应中,质子转移的平衡关系就叫做质子条件或质子平衡,它的数学表达式叫质子 等衡式,用 PBE 表示。 ㈠ 由物料平衡和电荷平衡方程导出质子条件 1.物料平衡(MBE) 物料平衡就是指在一个化学平衡体系中,某一给定组分的分析浓度(即总浓度)等于溶质各型体(即 各有关组分)平衡浓度的总和。物料平衡又叫质量平衡,用 MBE 表示。它的数学表达式叫做质量等衡式 或物料等衡式。也就是前面的分析浓度与平衡浓度间的关系式。 例 1:写出浓度为 Cmol/L 的 NaHCO3 溶液的物料等衡式。 解:(见课件) 例 2:写出浓度为 Cmol/L 的 Na2SO3 溶液的物料等衡式。 解:(见课件)) MBE 练习: 1:C mol/mL 的 HAC 的物料平衡式 C = [HAC] + [AC-] 2:C mol/mL 的 H3PO4 的物料平衡式 C = [H3PO4] + [H2PO4 - ] +[HPO4 2- ] + [PO4 3- ] 3: C mol/mL 的 Na2HPO4 的物料平衡式 [Na+ ] = 2C C = [H3PO4] + [H2PO4 - ] +[HPO4 2- ] + [PO4 3- ] 4: C mol/mL 的 NaHCO3 的物料平衡式 [Na+ ] = C C = [H2CO3] + [HCO3 - ] +[CO3 2- ] 2. 电荷平衡(CBE)(四师 P.91) 根据电中性的原则,单位体积中总的正电荷数等于总的负电荷数。或者说,反应处于平衡状态时,溶 液中正电荷的总浓度必等于负电荷的总浓度。这一规律称为电荷平衡,它的数学表达式叫做电荷等衡式或 电荷平衡方程,用 CBE 表示。 例 1:(见课件) 例 2:(见课件) 例 3:(见课件) CBE 练习:(见课件) 3. 由 MBE 和 CBE 导出 PBE(举例说明) 例 1:(见课件) 例 2:(见课件) ㈡ 由酸碱平衡体系中,得、失质子的物质的量应相等的原则直接导出质子条件 采用这种方法,首先必须选择合适的零水准物质,然后把由水准状态转变为获得质子的组分所得质子 的浓度之和列在等式的左边,把从水准状态转变为失去质子的各种组分所失去质子的浓度之和列在等式的 右边,这样的平衡关系就是质子条件
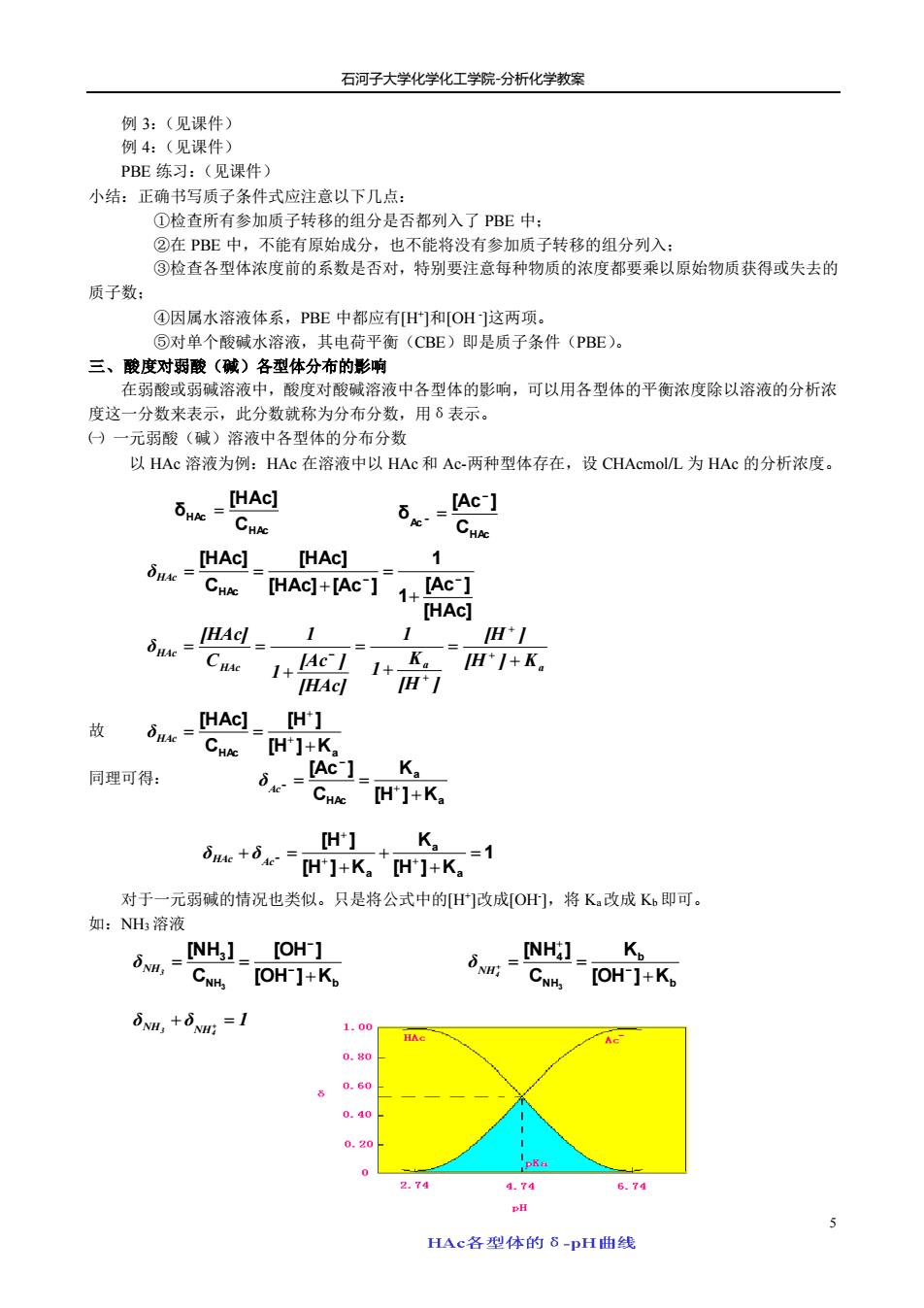
石河子大学化学化工学院分析化学教案 例3:(见课件) 例4:(见课件) PBE练习:(见课件) 小结:正确书写质子条件式应注意以下几点: ①检查所有参加质子转移的组分是否都列入了PBE中: ②在PBE中,不能有原始成分,也不能将没有参加质子转移的组分列入: ③检查各型体浓度前的系数是否对,特别要注意每种物质的浓度都要乘以原始物质获得或失去的 质子数: ④因属水溶液体系,PBE中都应有旧]和[OH这两项。 ⑤对单个酸碱水溶液,其电荷平衡(CBE)即是质子条件(PBE)。 三、酸度对弱酸(碱)各型体分布的影响 在弱酸或弱碱溶液中,酸度对酸碱溶液中各型体的影响,可以用各型体的平衡浓度除以溶液的分析浓 度这一分数来表示,此分数就称为分布分数,用8表示。 ()一元弱酸(碱)溶液中各型体的分布分数 以HAc溶液为例:HAc在溶液中以HAc和Ac两种型体存在,设CHAcmol/L为HAc的分析浓度。 bd [Ac-] L[HAC_HAc】 1 Cwe [HAc]+Ac】1+Ac-】 [HAc] 1 5nw-Cue 1 AeL H*1 1+ H*I+K。 故 dk=HAq.【H】 CHe [H']+K 同理可得: _[Ac-]_K, -]+K. H】 K。 iae+ie“H]+K+H们K,1 对于一元弱碱的情况也类似。只是将公式中的日们改成[O],将K.改成K。即可。 如:NH溶液 30,=INH] [OH CNH [OH ]+Kp CNH.[OH-]+K SNM,+6Nm:=1 1,00 0.80 0.40 0.20 2.74 4.74 6.74 DH HAc各型休的8-pH曲线
石河子大学化学化工学院-分析化学教案 5 例 3:(见课件) 例 4:(见课件) PBE 练习:(见课件) 小结:正确书写质子条件式应注意以下几点: ①检查所有参加质子转移的组分是否都列入了 PBE 中; ②在 PBE 中,不能有原始成分,也不能将没有参加质子转移的组分列入; ③检查各型体浓度前的系数是否对,特别要注意每种物质的浓度都要乘以原始物质获得或失去的 质子数; ④因属水溶液体系,PBE 中都应有[H+ ]和[OH - ]这两项。 ⑤对单个酸碱水溶液,其电荷平衡(CBE)即是质子条件(PBE)。 三、酸度对弱酸(碱)各型体分布的影响 在弱酸或弱碱溶液中,酸度对酸碱溶液中各型体的影响,可以用各型体的平衡浓度除以溶液的分析浓 度这一分数来表示,此分数就称为分布分数,用δ表示。 ㈠ 一元弱酸(碱)溶液中各型体的分布分数 以 HAc 溶液为例:HAc 在溶液中以 HAc 和 Ac-两种型体存在,设 CHAcmol/L 为 HAc 的分析浓度。 故 同理可得: 对于一元弱碱的情况也类似。只是将公式中的[H+ ]改成[OH- ],将 Ka改成 Kb 即可。 如:NH3 溶液 HAc HAc C [HAc] δ = HAc Ac C [Ac ] δ − − = [HAc] [Ac ] 1 1 [HAc] [Ac ] [HAc] C [HAc] HAc − − + = + δHAc = = HAc a a HAc [H ] K [H ] [H ] K 1 1 [HAc] [Ac ] 1 1 C [HAc] δ + = + = + = = + + + − HAc Ka [H ] [H ] C [HAc] + = = + + δHAc a a HAc [H ] K K C [Ac ] + = = + − − Ac δ 1 [H ] K K [H ] K [H ] a a a = + + + + = + + + − HAc Ac δ δ NH b 3 [OH ] K [OH ] C [NH ] 3 + = = − − NH3 δ b b NH 4 [OH ] K K C [NH ] 3 + = = − + + NH4 δ δ δ 1 4 NH3 NH + + =
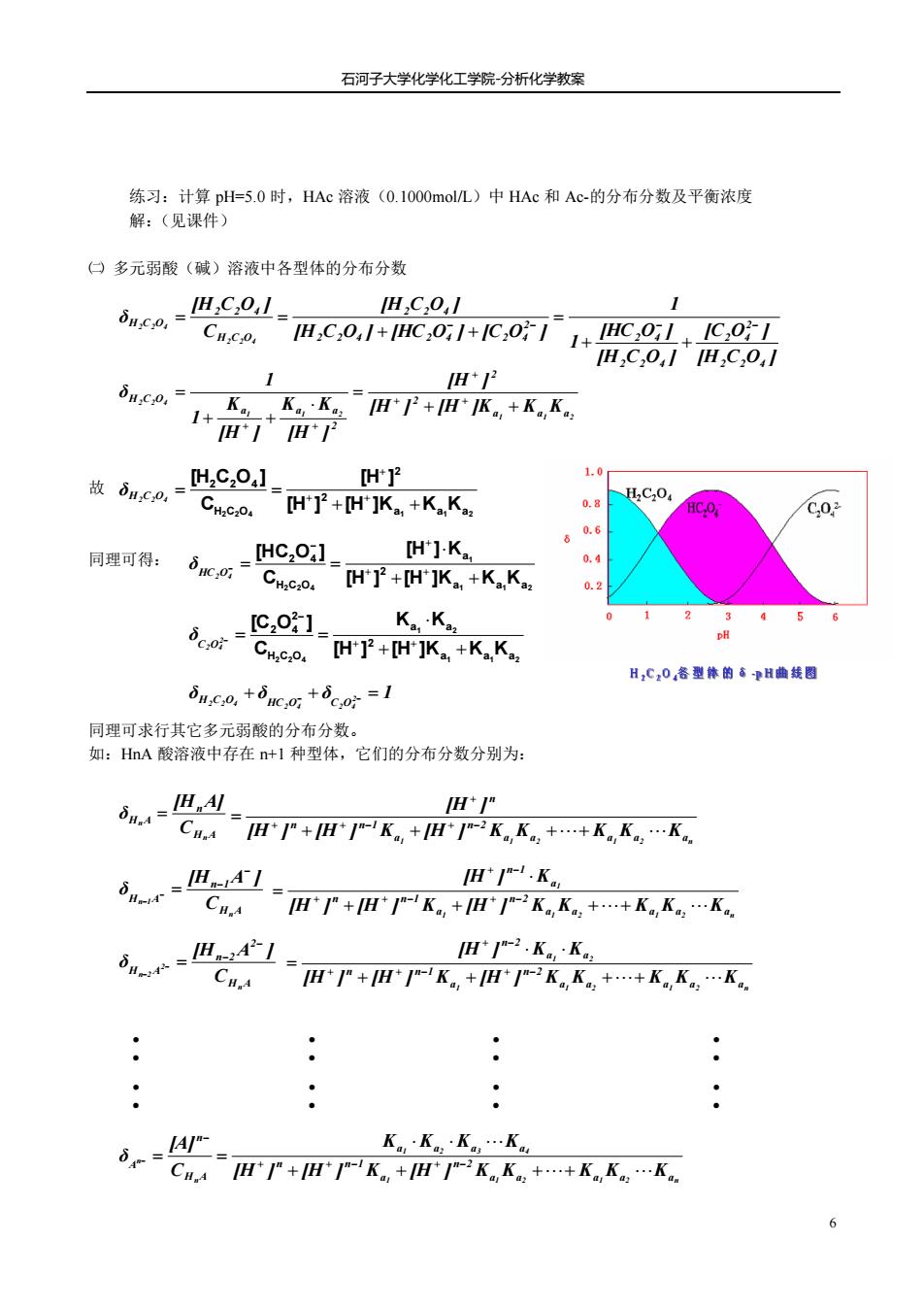
石河子大学化学化工学院分析化学教案 练习:计算plH=5.0时,HAc溶液(O.1OO0mol)中HAc和Ac-的分布分数及平衡浓度 解:(见课件) 口多元弱酸(碱)溶液中各型体的分布分数 iuo-IC0.1 H,C,0,/ 1 H,C,01+HC,01+1C,011+IHC0l+1C0I H,C,0,1H,C,0,/ H+2 u.C0= H*1H* 故d,co, HC20】」 [H'P2 Cwc.o.IH]+[H]K,+KK -H:C:O. HC.O /C,02 同理可得: dwc.=HC:0:] [H']K. a 0.s [H']2+[H']K,.+K.K. 0.2 [c,o1 Bc.= K。,K, coH了+H]K+KK H,C,0春型体的香H曲图 8ux.+c+c=1 同理可求行其它多元弱酸的分布分数。 如:HA酸溶液中存在+1种型体,它们的分布分数分别为: 6n.=IH.M CAH*P+瓜*-K。+瓜*=2K。K。,++K。K。,.K。 dvm= H-.K。 CHP+H-K,+H2KK++KK.K H12.K。,·K。, H*+H*K。+H1-之K。,K。++K。,K。,.K。 K·KK,.K。 CAH*严+H严K,+H*2K。K++K。,K,.K
石河子大学化学化工学院-分析化学教案 6 练习:计算 pH=5.0 时,HAc 溶液(0.1000mol/L)中 HAc 和 Ac-的分布分数及平衡浓度 解:(见课件) ㈡ 多元弱酸(碱)溶液中各型体的分布分数 故 同理可得: 同理可求行其它多元弱酸的分布分数。 如:HnA 酸溶液中存在 n+1 种型体,它们的分布分数分别为: [H C O ] [C O ] [H C O ] [HC O ] 1 1 [H C O ] [HC O ] [C O ] [H C O ] C [H C O ] δ 2 2 4 2 2 4 2 2 4 2 4 2 2 2 4 2 4 2 4 2 2 4 H C O 2 2 4 H C O 2 2 4 2 2 4 − − − − + + = + + = = 1 1 2 1 1 2 2 2 4 a a a 2 2 2 a a a H C O [H ] [H ]K K K [H ] [H ] K K [H ] K 1 1 δ + + = + + = + + + + + 2 2 4 a1 a1 a2 2 2 H C O 2 2 4 [H ] [H ]K K K [H ] C [H C O ] + + = = + + + H2C2O4 δ 1 1 2 1 2 2 4 a a a 2 a H C O 2 4 [H ] [H ]K K K [H ] K C [HC O ] + + = = + + − + − HC2O4 δ 1 1 2 1 2 2 2 4 a a a 2 a a H C O 2 2 4 [H ] [H ]K K K K K C [C O ] + + = = + + − 2− C2O4 δ δ δ δ 2 1 2 4 2 4 H2C2O4 HC O C O + − + − = H A n H A n n C [H A] δ = 1 a1 a2 a1 a2 an n 2 a n n 1 n [H ] [H ] K [H ] K K K K K [H ] + + ++ = + + − + − + H A n 1 H A n n 1 C [H A ] δ − − − = − 1 1 2 1 2 n 1 a a a a a n 2 a n n 1 a n 1 [H ] [H ] K [H ] K K K K K [H ] K + + ++ = + + − + − + − H A 2 n 2 H A n 2 n 2 C [H A ] δ − − − = − 1 1 2 1 2 n 1 2 a a a a a n 2 a n n 1 a a n 2 [H ] [H ] K [H ] K K K K K [H ] K K + + ++ = + + − + − + − H A n A n n C [A] δ − − = ∶ ∶ ∶ ∶ ∶ ∶ ∶ ∶ 1 1 2 1 2 n 1 2 3 4 a a a a a n 2 a n n 1 a a a a [H ] [H ] K [H ] K K K K K K K K K + + + + = + + − + −