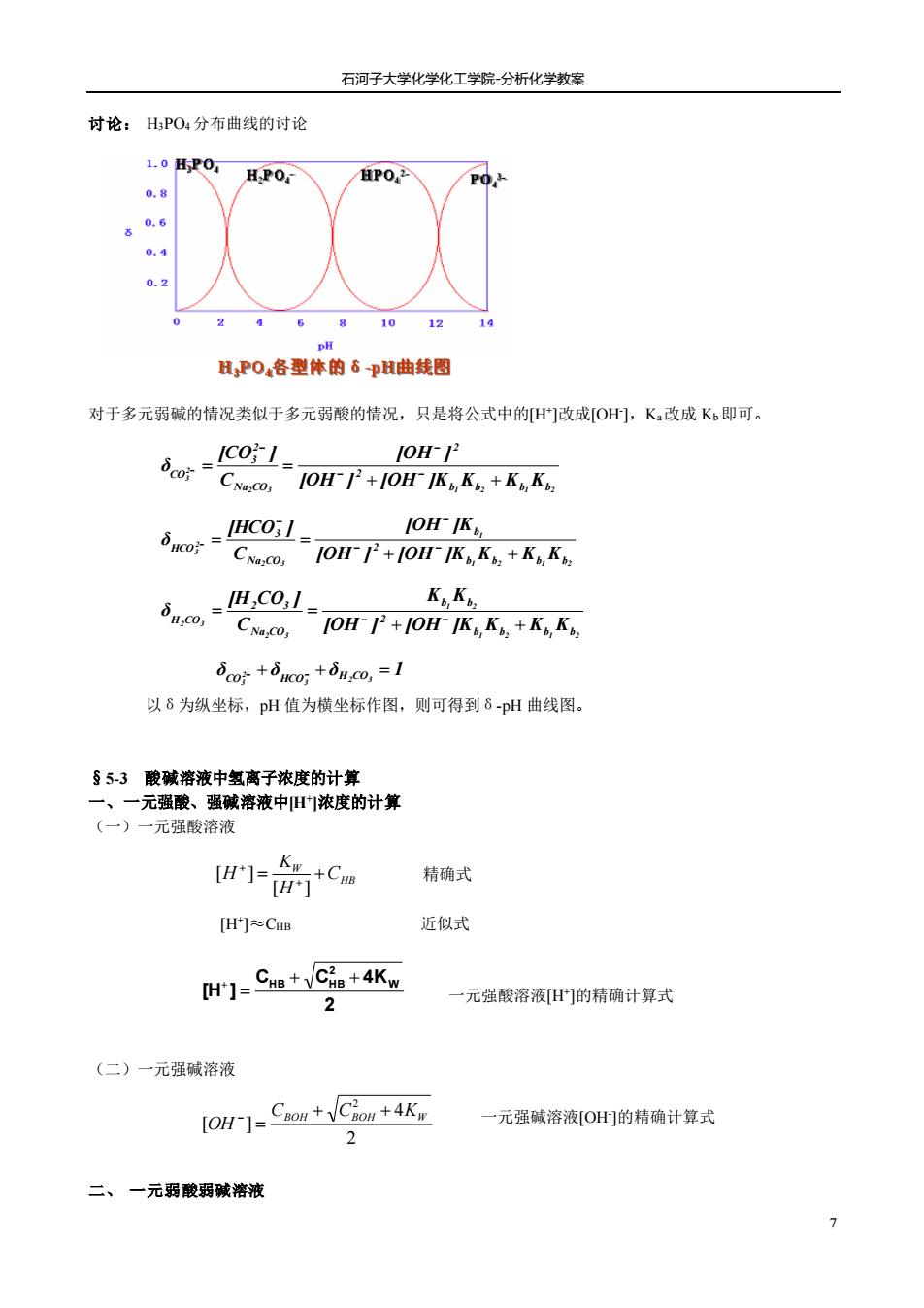
石河子大学化学化工学院分析化学教案 讨论:HPO:分布曲线的讨论 1.0HP0 HP0.2 0.8 0.6 2468101214 H,P0,各型体的6pH曲线图 对于多元弱碱的情况类似于多元弱酸的情况,只是将公式中的H]改成OH,K改成K即可。 10H- CNa: 1OH-+0H IK,K+KK JOH IK. CNa:co,0H-+0H-IK K+KK w Ko.K. IOH-P+H-IK K+KK do时+dhco,+da,o,=1 以6为纵坐标,pH值为横坐标作图,则可得到6-pH曲线图。 §5-3酸碱溶液中氢离子浓度的计算 一、一元强酸、强碱溶液中旧浓度的计算 (一)一元强酸溶液 wI六+ca 精确式 [Hr门≈CHB 近似式 H]=Ce+Ci品+4Kn 2 元强酸溶液门的精确计算式 (二)一元强碱溶液 [OH ]Coou+Cion +4K 一元强碱溶液[O的精确计算式 2 二、一元弱酸弱碱溶液
石河子大学化学化工学院-分析化学教案 7 讨论: H3PO4 分布曲线的讨论 对于多元弱碱的情况类似于多元弱酸的情况,只是将公式中的[H+ ]改成[OH- ],Ka改成 Kb 即可。 以δ为纵坐标,pH 值为横坐标作图,则可得到δ-pH 曲线图。 §5-3 酸碱溶液中氢离子浓度的计算 一、一元强酸、强碱溶液中[H+ ]浓度的计算 (一)一元强酸溶液 精确式 [H+ ]≈CHB 近似式 一元强酸溶液[H+ ]的精确计算式 (二)一元强碱溶液 一元强碱溶液[OH- ]的精确计算式 二、 一元弱酸弱碱溶液 2 4 [ ] 2 CBOH CBOH KW OH + + = − HB W C H K H = + + + [ ] [ ] 2 3 1 2 1 2 2 3 b b b b 2 2 Na CO 2 3 CO [OH ] [OH ]K K K K [OH ] C [CO ] δ + + = = − − − − − 1 2 1 2 1 2 3 2 3 b b b b 2 b Na CO 3 HCO [OH ] [OH ]K K K K [OH ]K C [HCO ] δ + + = = − − − − − 1 2 1 2 1 2 2 3 2 3 b b b b 2 b b Na CO 2 3 H CO [OH ] [OH ]K K K K K K C [H CO ] δ + + = = − − δ δ δ 1 2 3 3 2 3 CO − + HCO− + H CO = 2 C C 4K [H ] W 2 HB + HB + = +

石河子大学化学化工学院分析化学教案 (一)一元弱酸(HA)溶液 ①当C·K。<20Kw,CK<400时,简化精确式的质子条件式 [H']=K,[HA]+Kw 精确式 ②当CK<20Kw,CK.>400时 H]=√KC+Kw 近似式1 ③当CK>20Kw,CK<400时, [H]-K.+/K.+4K.C 近似式2 2 ④当CK>20Kw,C/K>400时 [H']=K,C 最简式 (二)一元弱碱(B)溶液 ①当C·K<20Kw,CK6<400时,用精确式计算: [OH]=√K[B]+K ②当C·Kb>20Kw,C/Kb>400时,可用最简式计算 [OH]=√K。C ③当C·Kb>20Kw,CKb<400时,可用近似式2计算: OH1=-K,+K2+4K,C ④当C·Kb<20Kw,C/Kb>400时,可用近似式1计算: [OH]=VK。C+Ke 例:(四师P100,例5-3,5-4,5-5,5-6) 三、多元弱酸(碱)溶液门的计算 (一)多元弱酸溶液酸度的计算 多元弱酸在溶液中是逐级离解的,例如:HPO:在H0中分三步离解: 得 .o H20 H/2 3H 当C·Ka1>20Kw,C/Ka>400时,可用最简式计算: [H']=K.,C 当C·K>20Kw,CKa1<400时,可用近似式2计算:
石河子大学化学化工学院-分析化学教案 8 (一) 一元弱酸(HA)溶液 ① 当 C·Ka < 20KW , C/Ka<400 时,简化精确式的质子条件式 精确式 ②当 C·Ka < 20KW , C/Ka>400 时 近似式 1 ③当 C·Ka>20Kw,C/Ka<400 时, 近似式 2 ④当 C·Ka>20Kw,C/Ka>400 时 最简式 (二)一元弱碱(B)溶液 ①当 C·Kb < 20Kw , C/Kb<400 时,用精确式计算: ② 当 C·Kb>20Kw,C/Kb>400 时,可用最简式计算: ③当 C·Kb>20Kw,C/Kb<400 时,可用近似式 2 计算: ④当 C·Kb<20Kw,C/Kb>400 时,可用近似式 1 计算: 例:(四师 P.100,例 5-3,5-4,5-5,5-6) 三、 多元弱酸(碱)溶液[H+ ]的计算 (一)多元弱酸溶液酸度的计算 多元弱酸在溶液中是逐级离解的,例如:H3PO4 在 H2O 中分三步离解: ① 可按一元弱酸的计算公式求溶液中的[H+]。 即 当 C·Ka1>20Kw,C/Ka1>400 时,可用最简式计算: 当 C·Ka1>20Kw,C/Ka1<400 时,可用近似式 2 计算: [H ] = Ka [HA]+KW + [H ] = Ka C+KW + 2 K K 4K C [H ] a 2 − a + a + = + [H ] = Ka C + OH Kb B + KW = − [ ] [ ] OH = Kb C − [ ] 2 4 [ ] 2 K K K C OH − b + b + b = − OH Kb C + KW = − [ ] [H ] K C a1 = +