
《分析化学实验》指导书 辽宁石油化工大学石油化工学院 二00六年七月印刷
《分析化学实验》指导书 辽宁石油化工大学石油化工学院 二 0 0 六年七月印刷

实验一 容器仪器的洗涤、使用及酸碱溶液 的配制和相互滴定 实验项目性质:验证性 所属课程名称:《分析化学》 实验计划学时:4 一、实验目的 1.掌握酸、碱标准溶液的配制方法: 2练习滴定操作,正确判断滴定终点 3.熟悉甲基橙和酚酞指示剂的使用和终点时颜色的变化。初步掌握酸碱指示剂的选择方法。 二、实验内容和要求 1.实验内容 (1)酸碱溶液的配制:(2)酸碱溶液相互滴定: 2.实验要求 通过本课程的学习,使学生掌握酸碱溶液的配制方法,理解酸碱滴定的基本原理,培养学生 理论联系实际,分析问题和解决问题的能力。 三、实验仪器、设备及材料 1.化学试剂 NaOH固体,分析纯: 浓盐酸,密度为1.19g/cm3 酚酞0.2%乙醇溶液:甲基橙0.2%水溶液。 2.仪器和设备 常规玻璃仪器,托盘天平等。 四、实验原理 酸碱滴定中,通常将HC和NaOH标准溶液作为滴定剂。由于HCI易挥发,NaOH易吸收 空气中的水和二氧化破,因此不宜用直接法配制,而采用先配制成近似浓度的溶液,然后用基准 物质标定其准确浓度,也可用另一己知准确浓度的标准溶液滴定该溶液,再根据它们的体积比求 出该溶液的浓度。 酸碱指示剂都具有一定的变色范围,HC和NaOH的滴定突跃范围PH约为4一-10,应当选 用在此范围内变色的指示剂,例如甲基橙(变色范围3.14.4)或酚酞(变色范用PH8.0-9.6)等指示剂 来指示滴定终点。 五、实验步骤
1 实验一 容器仪器的洗涤、使用及酸碱溶液 的配制和相互滴定 实验项目性质:验证性 所属课程名称:《分析化学》 实验计划学时:4 一、实验目的 1.掌握酸、碱标准溶液的配制方法; 2.练习滴定操作,正确判断滴定终点; 3.熟悉甲基橙和酚酞指示剂的使用和终点时颜色的变化。初步掌握酸碱指示剂的选择方法。 二、实验内容和要求 1. 实验内容 (1)酸碱溶液的配制;(2)酸碱溶液相互滴定; 2.实验要求 通过本课程的学习,使学生掌握酸碱溶液的配制方法,理解酸碱滴定的基本原理,培养学生 理论联系实际,分析问题和解决问题的能力。 三、实验仪器、设备及材料 1. 化学试剂 NaOH 固体,分析纯; 浓盐酸,密度为 1.19 3 g cm ; 酚酞 0.2%乙醇溶液;甲基橙 0.2%水溶液。 2. 仪器和设备 常规玻璃仪器,托盘天平等。 四、实验原理 酸碱滴定中,通常将 HCl 和 NaOH 标准溶液作为滴定剂。由于 HCl 易挥发,NaOH 易吸收 空气中的水和二氧化破,因此不宜用直接法配制,而采用先配制成近似浓度的溶液,然后用基准 物质标定其准确浓度,也可用另一已知准确浓度的标准溶液滴定该溶液,再根据它们的体积比求 出该溶液的浓度。 酸碱指示剂都具有一定的变色范围,HCl 和 NaOH 的滴定突跃范围 PH 约为 4—10,应当选 用在此范围内变色的指示剂,例如甲基橙(变色范围 3.1-4.4)或酚酞(变色范围 PH8.0-9.6)等指示剂 来指示滴定终点。 五、实验步骤
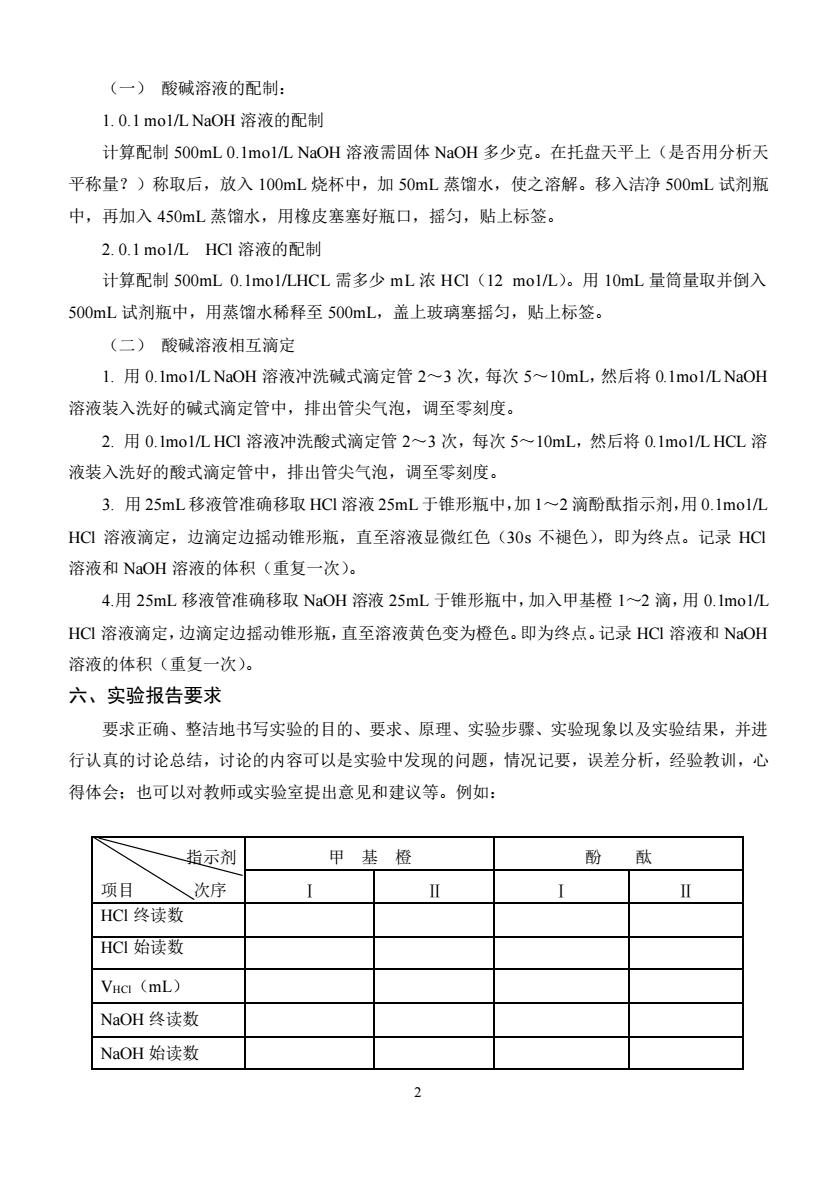
(一)酸碱溶液的配制: 1.0.1mol/LNaOH溶液的配制 计算配制500mL0.1 no1/L NaOH溶液需固体NaOH多少克。在托盘天平上(是否用分析天 平称量?)称取后,放入100mL烧杯中,加50mL蒸馏水,使之溶解。移入洁净500mL试剂瓶 中,再加入450mL蒸馏水,用橡皮塞塞好瓶口,摇匀,贴上标签 2.0.1 mo1/L HCI溶液的配制 计算配制500mL0.1mo1/LHCL需多少mL浓HC(12molL)。用10mL量筒量取并倒入 500mL试剂瓶中,用蒸馏水稀释至500mL,盖上玻璃塞摇匀,贴上标签。 (二)酸碱溶液相互滴定 1.用0.1mo1/LNaOH溶液冲洗碱式滴定管2~3次,每次5~10mL,然后将0.1 mo1/L NaOH 溶液装入洗好的碱式滴定管中,排出管尖气泡,调至零刻度。 2.用0.1mo1LHC1溶液冲洗酸式滴定管2~3次,每次5~10mL,然后将0.1mo1LHCL溶 液装入洗好的酸式滴定管中,排出管尖气泡,调至零刻度。 3.用25mL移液管准确移取HC1溶液25mL于锥形瓶中,加1~2滴酚酞指示剂,用0.1molL HC溶液滴定,边滴定边摇动锥形瓶,直至溶液显微红色(30s不褪色),即为终点。记录HC 溶液和NaOH溶液的体积(重复一次)。 4.用25mL移液管准确移取NaOH溶液25mL于锥形瓶中,加入甲基橙1~2滴,用0.Imol/L HC溶液滴定,边滴定边摇动锥形瓶,直至溶液黄色变为橙色。即为终点。记录HCI溶液和NaOH 溶液的体积(重复一次)。 六、实验报告要求 要求正确、整洁地书写实验的目的、要求、原理、实验步骤、实验现象以及实验结果,并进 行认真的讨论总结,讨论的内容可以是实验中发现的问题,情况记要,误差分析,经验教训,心 得体会:也可以对教师或实验室提出意见和建议等。例如: 一指示剂 甲基橙 项目 、次序 HC1终读数 HC始读数 VHc (mL) NaOH终读数 NaOH始读数 2
2 (一) 酸碱溶液的配制: 1. 0.1 mo1/L NaOH 溶液的配制 计算配制 500mL 0.1mo1/L NaOH 溶液需固体 NaOH 多少克。在托盘天平上(是否用分析天 平称量?)称取后,放入 100mL 烧杯中,加 50mL 蒸馏水,使之溶解。移入洁净 500mL 试剂瓶 中,再加入 450mL 蒸馏水,用橡皮塞塞好瓶口,摇匀,贴上标签。 2. 0.1 mo1/L HCl 溶液的配制 计算配制 500mL 0.1mo1/LHCL 需多少 mL 浓 HCl(12 mo1/L)。用 10mL 量筒量取并倒入 500mL 试剂瓶中,用蒸馏水稀释至 500mL,盖上玻璃塞摇匀,贴上标签。 (二) 酸碱溶液相互滴定 1. 用 0.1mo1/L NaOH 溶液冲洗碱式滴定管 2~3 次,每次 5~10mL,然后将 0.1mo1/L NaOH 溶液装入洗好的碱式滴定管中,排出管尖气泡,调至零刻度。 2. 用 0.1mo1/L HCl 溶液冲洗酸式滴定管 2~3 次,每次 5~10mL,然后将 0.1mo1/L HCL 溶 液装入洗好的酸式滴定管中,排出管尖气泡,调至零刻度。 3. 用 25mL 移液管准确移取 HCl 溶液 25mL 于锥形瓶中,加 1~2 滴酚酞指示剂,用 0.1mo1/L HCl 溶液滴定,边滴定边摇动锥形瓶,直至溶液显微红色(30s 不褪色),即为终点。记录 HCl 溶液和 NaOH 溶液的体积(重复一次)。 4.用 25mL 移液管准确移取 NaOH 溶液 25mL 于锥形瓶中,加入甲基橙 1~2 滴,用 0.1mo1/L HCl 溶液滴定,边滴定边摇动锥形瓶,直至溶液黄色变为橙色。即为终点。记录 HCl 溶液和 NaOH 溶液的体积(重复一次)。 六、实验报告要求 要求正确、整洁地书写实验的目的、要求、原理、实验步骤、实验现象以及实验结果,并进 行认真的讨论总结,讨论的内容可以是实验中发现的问题,情况记要,误差分析,经验教训,心 得体会;也可以对教师或实验室提出意见和建议等。例如: 指示剂 项目 次序 甲 基 橙 酚 酞 Ⅰ Ⅱ Ⅰ Ⅱ HCl 终读数 HCl 始读数 VHCl(mL) NaOH 终读数 NaOH 始读数

VNaOH (mL) VHCI/VNOH 平均值 相对误差 七、实验注意事项 1.中使用酸碱时,尤其是浓酸碱时,应注意防护,保证安全。 2.准确使用滴定分析器皿是获得好的分析结果的重要因素,因此在此实验前,应认真掌握滴 定分析器皿的正确使用方法。 3.观察实验过程中所出现的现象,尤其是颜色变化,并认真记录。 八、思考题 1用滴定管装标准溶液之前,为什么要用标准溶液冲洗2~3次,所用的锥形瓶是否也需用 标准溶液冲洗?为什么? 2.用50mL的滴定管,若滴定第一份试液用去20mL(管内还剩30mL),滴定第二份试液(也 约需20mL)时,是继续用剩的溶液滴定,还是将溶液添加至“零”刻度再滴定?为什么? 3.HCI溶液和NaOH溶液定量反应完全后,生成NaCI和H,O,为什么用HCI滴定NaOH时 采用甲基橙为指示剂,而用NaOH滴定HC1时却用酚酞,为什么? 4滴定管、移液管、容量瓶都是准确量具,记录时应取几位有效数字? 5.配制HC和NaOH溶液,需加蒸馏水时,是否要准确量度其体积?为什么? 实验二分析天平的称量方法练习 实验项目性质:验证性 所属课程名称:《分析化学》 实验计划学时:4 一、实验目的 1.了解天平的称量原理,学会正确使用天平。 2.掌握天平的零点、灵敏度的测定方法及直接称量和间接称量方法。 二、实验内容和要求 1实验内容 (1)灵敏度的测定: (2)直接称量法: (3)减量称量法。 2
3 VNaOH(mL) VHCl / VNaOH 平均值 相对误差 七、实验注意事项 1.中使用酸碱时,尤其是浓酸碱时,应注意防护,保证安全。 2.准确使用滴定分析器皿是获得好的分析结果的重要因素,因此在此实验前,应认真掌握滴 定分析器皿的正确使用方法。 3.观察实验过程中所出现的现象,尤其是颜色变化,并认真记录。 八、思考题 1.用滴定管装标准溶液之前,为什么要用标准溶液冲洗 2~3 次,所用的锥形瓶是否也需用 标准溶液冲洗?为什么? 2.用 50mL 的滴定管,若滴定第一份试液用去 20mL(管内还剩 30mL), 滴定第二份试液(也 约需 20mL)时,是继续用剩的溶液滴定,还是将溶液添加至“零”刻度再滴定?为什么? 3.HCl 溶液和 NaOH 溶液定量反应完全后,生成 NaCl 和 H2O,为什么用 HCl 滴定 NaOH 时 采用甲基橙为指示剂,而用 NaOH 滴定 HCl 时却用酚酞,为什么? 4.滴定管、移液管、容量瓶都是准确量具,记录时应取几位有效数字? 5.配制 HCl 和 NaOH 溶液,需加蒸馏水时,是否要准确量度其体积?为什么? 实验二 分析天平的称量方法练习 实验项目性质:验证性 所属课程名称:《分析化学》 实验计划学时:4 一、实验目的 1.了解天平的称量原理,学会正确使用天平。 2.掌握天平的零点、灵敏度的测定方法及直接称量和间接称量方法。 二、实验内容和要求 1 实验内容 (1)灵敏度的测定; (2)直接称量法; (3)减量称量法

2实验要求 通过本课程的学习,使学生掌握天平的零点、灵敏度的测定方法及直接称量和间接称量方法, 理解天平的称量原理基本原理,培养学生理论联系实际,分析问题和解决问题的能力。 三、实验仪器、设备及材料 1.化学试剂 NaCO3(或固体试样) 2.仪器和设备 分析天平,托盘天平,电子天平,瓷坩埚,称量瓶 四、实验原理 分析天平是根据杠杆原理设计而成的,每一项定量分析工作都直接或间接地需要使用天平, 常用的分析天平有阻尼天平、半自动电光天平、全自动电光天平、单盘电光天平、微量天平和电 子天平等。 设有杠杆ABC,B为支点,A为重点,C为力点,Q为被称物品质量,P为砝码总质量。 当平衡时:Q×AB=P×BC:天平两臂相等AB=BC,故Q=P,所以砝码的总质量等于被称物品质 量。 天平的灵敏度:天平的灵敏度一般是指天平盘上增加1mg所引起的指针在读数标牌上偏移 的格数,灵敏度(E)的单位为分度/mg,在实际工作中,常用灵敏度的倒数来表示天平的的灵敏 程度,即 s=1/E(mg分度) 5称为天平的分度使,也称感量,单位为毫克/分度。因此,分度使是使天平的平衡位置 产生一个分度变化时所需要的重量值(毫克数)。可见,分度值越小的天平,其灵敏度越高。例如 某天平的灵敏度为2.5分度/mg,则该天平的分度值为: s=1/E=0.4(mg分度) 五、实验步骤 1.使用分析天平称量前的准备工作: (1)取下天平罩,叠好后平放在天平箱右后方的台面上或天平箱的项上。 (2)称量时,操作者面对天平端坐,记录本放在胸前的台面上,存放和接受称量物的器皿放 在天平箱左侧,祛码盒放在右侧。 (3)称量开始前应作如下检查和调整: ā了解持称物体的湿度与天平箱里的温度是否相同。如果待称物体曾经加热或冷却过,必须 将该物体放置在天平箱近旁相当时间,待该物体的温度与天平箱里的湿度相同后再进行称量。盛
4 2 实验要求 通过本课程的学习,使学生掌握天平的零点、灵敏度的测定方法及直接称量和间接称量方法, 理解天平的称量原理基本原理,培养学生理论联系实际,分析问题和解决问题的能力。 三、实验仪器、设备及材料 1. 化学试剂 Na2CO3(或固体试样) 2. 仪器和设备 分析天平,托盘天平,电子天平,瓷坩埚,称量瓶 四、实验原理 分析天平是根据杠杆原理设计而成的,每一项定量分析工作都直接或间接地需要使用天平, 常用的分析天平有阻尼天平、半自动电光天平、全自动电光天平、单盘电光天平、微量天平和电 子天平等。 设有杠杆 ABC, B 为支点,A 为重点,C 为力点,Q 为被称物品质量,P 为砝码总质量。 当平衡时;Q×AB=P×BC;天平两臂相等 AB=BC,故 Q=P,所以砝码的总质量等于被称物品质 量。 天平的灵敏度:天平的灵敏度一般是指天平盘上增加 1mg 所引起的指针在读数标牌上偏移 的格数,灵敏度(E)的单位为分度/mg,在实际工作中,常用灵敏度的倒数来表示天平的的灵敏 程度,即 s=1/E(mg/分度) s 称为天平的分度使,也称感量,单位为毫克/分度。因此,分度使是使天平的平衡位置 产生一个分度变化时所需要的重量值(毫克数)。可见,分度值越小的天平,其灵敏度越高。例如, 某天平的灵敏度为 2.5 分度/mg,则该天平的分度值为: s=1/E=0.4(mg/分度) 五、实验步骤 1.使用分析天平称量前的准备工作: (1)取下天平罩,叠好后平放在天平箱右后方的台面上或天平箱的顶上。 (2)称量时,操作者面对天平端坐,记录本放在胸前的台面上,存放和接受称量物的器皿放 在天平箱左侧,祛码盒放在右侧。 (3)称量开始前应作如下检查和调整: a.了解持称物体的湿度与天平箱里的温度是否相同。如果待称物体曾经加热或冷却过,必须 将该物体放置在天平箱近旁相当时间,待该物体的温度与天平箱里的湿度相同后再进行称量。盛