
第五节 蛋白质 蛋白质存在于一切生物体内,在细胞的结构和功能中起着十分重要的作用。 根据蛋白质的元素分析,发现其元素组成与糖类和脂类不同,除含有碳、氢、氧 以外,还含有氮和少量的硫,有些还含有磷、铁、铜、碘、锌、钼等。蛋白质的 平均含氮量为 16%,这是凯氏定氮法测定蛋白质含量的计算依据。蛋白质的基本 结构单位是氨基酸,蛋白质分子中的氨基酸残基依靠肽键连接。生物界中蛋白质 的种类数估计在 1010~1012 数量级之间,造成种类如此众多的原因,主要是 20 种参与蛋白质组成的氨基酸在肽链中的排列顺序不同所引起的。蛋白质的这种顺 序异构现象是蛋白质生物功能多样化和种属特异性的结构基础。 根据其分子组成,蛋白质可以分为两类。有些蛋白质完全由氨基酸构成,称 为简单蛋白质。简单蛋白质又可根据其物理化学性质分为清蛋白、球蛋白、谷蛋 白、醇溶蛋白、组蛋白、鱼精蛋白、硬蛋白等。而另有一些蛋白质除了蛋白质部 分外,还含有非蛋白质成分,这类蛋白质称为结合蛋白质。结合蛋白质的非蛋白 质部分称为辅助因子。结合蛋白质又可按辅助因子成分分为核蛋白、脂蛋白、糖 蛋白、磷蛋白、血红素蛋白、黄素蛋白、金属蛋白等等。 每一种蛋白质都有其特定的三维结构。蛋白质分子中氨基酸的排列顺序仅仅 是蛋白质最基本的结构,叫做蛋白质的一级结构。而蛋白质的二级结构和三级结 构与多肽链三维结构有关。有些蛋白质由数条充分折叠、卷曲的多肽链缔合,组 成蛋白质的最高级结构,称为四级结构。在蛋白质的四级结构中,具有三级结构 的多肽链单元称为亚基。蛋白质的三维结构主要由一些非共价键维系。 食品加工的对象是一切具有可食特性的生物材料,而所有的生物材料中都含 有蛋白质。蛋白质是食品的主要营养成分,它除了为机体提供各种氨基酸和含氮 物质所需的氮源外,在决定食品的色、香、味及结构特征上都有很重要的作用。 因此,了解蛋白质的组成、结构、功能和性质,及其在加工过程中所发生的变化, 具有很重要的实际意义。 一、蛋白质的结构及其中的主要作用力 蛋白质是以氨基酸为单位而构成的大分子物质,结构非常复杂。蛋白质的一 级结构是指蛋白质分子中氨基酸的连接方式和排列顺序。在蛋白质分子中氨基酸 彼此以肽键相连呈链状结构。肽链中的肽键是一个氨基酸的羧基与另一个氨基酸 的氨基脱水缩合而成的酰胺键。蛋白质一级结构不但影响蛋白质的基本性质,也 会使二级和三级结构有所不同。蛋白质的二级结构是指蛋白质分子中多肽链本身 的折叠方式。多肽链的二级结构主要是 -螺旋结构和β-折叠结构。它们是依靠 分子内形成的氢键维持其稳定性。二级结构的肽链进一步折叠、卷曲可形成复杂 的三级结构。蛋白质的三级结构大部分为球形,但也有纤维状等其他形状的蛋白 质。稳定蛋白质三级结构的化学键有离子键、氢键、二硫键、范德华力及非极性 的疏水作用力等,这些作用力和键可统称为次级键。在蛋白质三级结构中,依靠 次级键作用,亲水性的极性 R 基团位于分子表面,而非极性的 R 基团则位于分 子内部,从而提高了蛋白质在水溶液中的溶解度。蛋白质四级结构是指在三级结 构基础上两条或多条多肽链以特殊方式结合形成的有生物活性的蛋白质。例如, 血红蛋白是由两条 -链和两条β-链组成的聚合体,这些多肽链称为亚基或亚单
第五节 蛋白质 蛋白质存在于一切生物体内,在细胞的结构和功能中起着十分重要的作用。 根据蛋白质的元素分析,发现其元素组成与糖类和脂类不同,除含有碳、氢、氧 以外,还含有氮和少量的硫,有些还含有磷、铁、铜、碘、锌、钼等。蛋白质的 平均含氮量为 16%,这是凯氏定氮法测定蛋白质含量的计算依据。蛋白质的基本 结构单位是氨基酸,蛋白质分子中的氨基酸残基依靠肽键连接。生物界中蛋白质 的种类数估计在 1010~1012 数量级之间,造成种类如此众多的原因,主要是 20 种参与蛋白质组成的氨基酸在肽链中的排列顺序不同所引起的。蛋白质的这种顺 序异构现象是蛋白质生物功能多样化和种属特异性的结构基础。 根据其分子组成,蛋白质可以分为两类。有些蛋白质完全由氨基酸构成,称 为简单蛋白质。简单蛋白质又可根据其物理化学性质分为清蛋白、球蛋白、谷蛋 白、醇溶蛋白、组蛋白、鱼精蛋白、硬蛋白等。而另有一些蛋白质除了蛋白质部 分外,还含有非蛋白质成分,这类蛋白质称为结合蛋白质。结合蛋白质的非蛋白 质部分称为辅助因子。结合蛋白质又可按辅助因子成分分为核蛋白、脂蛋白、糖 蛋白、磷蛋白、血红素蛋白、黄素蛋白、金属蛋白等等。 每一种蛋白质都有其特定的三维结构。蛋白质分子中氨基酸的排列顺序仅仅 是蛋白质最基本的结构,叫做蛋白质的一级结构。而蛋白质的二级结构和三级结 构与多肽链三维结构有关。有些蛋白质由数条充分折叠、卷曲的多肽链缔合,组 成蛋白质的最高级结构,称为四级结构。在蛋白质的四级结构中,具有三级结构 的多肽链单元称为亚基。蛋白质的三维结构主要由一些非共价键维系。 食品加工的对象是一切具有可食特性的生物材料,而所有的生物材料中都含 有蛋白质。蛋白质是食品的主要营养成分,它除了为机体提供各种氨基酸和含氮 物质所需的氮源外,在决定食品的色、香、味及结构特征上都有很重要的作用。 因此,了解蛋白质的组成、结构、功能和性质,及其在加工过程中所发生的变化, 具有很重要的实际意义。 一、蛋白质的结构及其中的主要作用力 蛋白质是以氨基酸为单位而构成的大分子物质,结构非常复杂。蛋白质的一 级结构是指蛋白质分子中氨基酸的连接方式和排列顺序。在蛋白质分子中氨基酸 彼此以肽键相连呈链状结构。肽链中的肽键是一个氨基酸的羧基与另一个氨基酸 的氨基脱水缩合而成的酰胺键。蛋白质一级结构不但影响蛋白质的基本性质,也 会使二级和三级结构有所不同。蛋白质的二级结构是指蛋白质分子中多肽链本身 的折叠方式。多肽链的二级结构主要是 -螺旋结构和β-折叠结构。它们是依靠 分子内形成的氢键维持其稳定性。二级结构的肽链进一步折叠、卷曲可形成复杂 的三级结构。蛋白质的三级结构大部分为球形,但也有纤维状等其他形状的蛋白 质。稳定蛋白质三级结构的化学键有离子键、氢键、二硫键、范德华力及非极性 的疏水作用力等,这些作用力和键可统称为次级键。在蛋白质三级结构中,依靠 次级键作用,亲水性的极性 R 基团位于分子表面,而非极性的 R 基团则位于分 子内部,从而提高了蛋白质在水溶液中的溶解度。蛋白质四级结构是指在三级结 构基础上两条或多条多肽链以特殊方式结合形成的有生物活性的蛋白质。例如, 血红蛋白是由两条 -链和两条β-链组成的聚合体,这些多肽链称为亚基或亚单
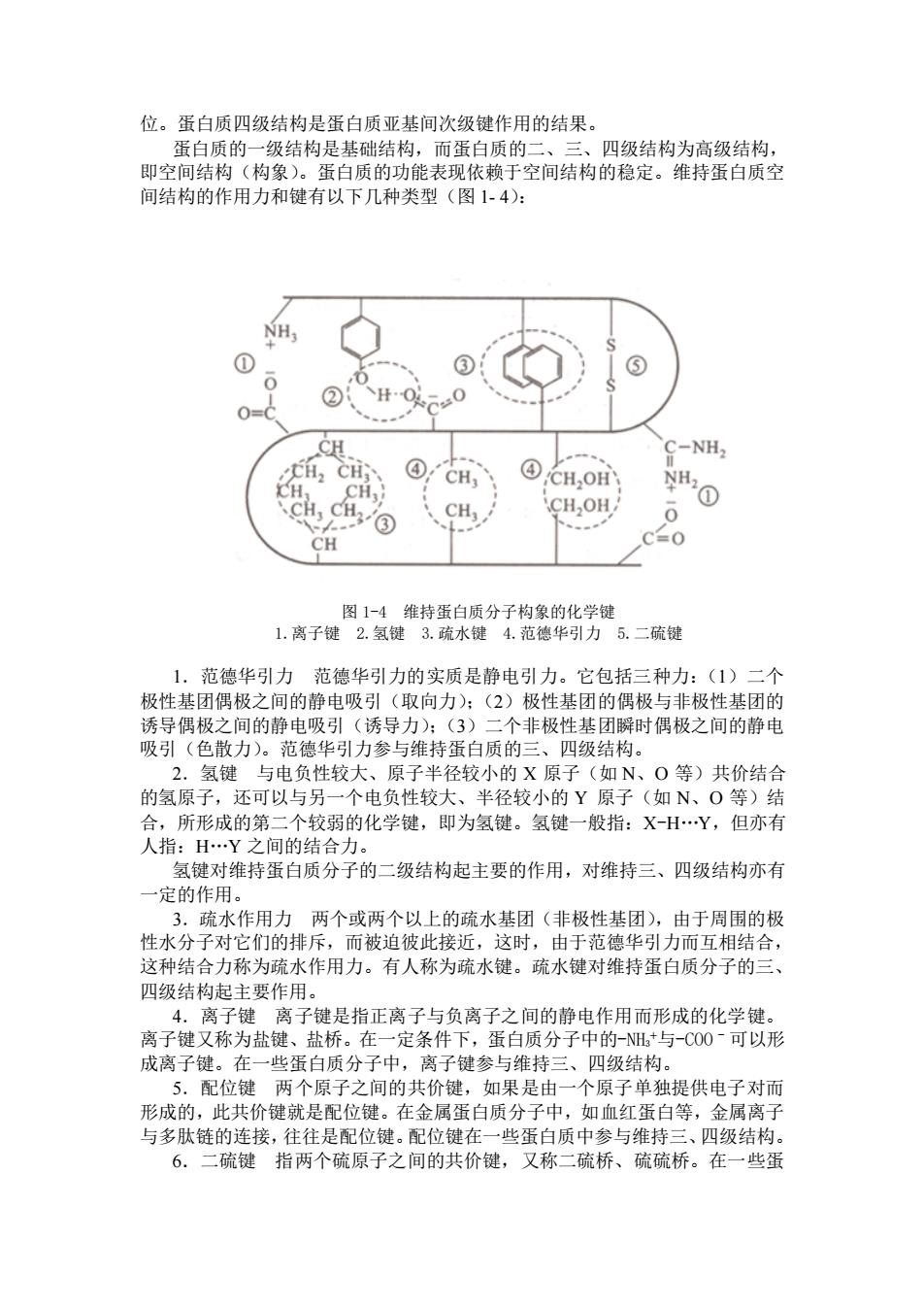
位。蛋白质四级结构是蛋白质亚基间次级键作用的结果。 蛋白质的一级结构是基础结构,而蛋白质的二、三、四级结构为高级结构, 即空间结构(构象)。蛋白质的功能表现依赖于空间结构的稳定。维持蛋白质空 间结构的作用力和键有以下几种类型(图 1- 4): 图 1-4 维持蛋白质分子构象的化学键 1.离子键 2.氢键 3.疏水键 4.范德华引力 5.二硫键 1.范德华引力 范德华引力的实质是静电引力。它包括三种力:(1)二个 极性基团偶极之间的静电吸引(取向力);(2)极性基团的偶极与非极性基团的 诱导偶极之间的静电吸引(诱导力);(3)二个非极性基团瞬时偶极之间的静电 吸引(色散力)。范德华引力参与维持蛋白质的三、四级结构。 2.氢键 与电负性较大、原子半径较小的 X 原子(如 N、O 等)共价结合 的氢原子,还可以与另一个电负性较大、半径较小的 Y 原子(如 N、O 等)结 合,所形成的第二个较弱的化学键,即为氢键。氢键一般指:X-H.Y,但亦有 人指:H.Y 之间的结合力。 氢键对维持蛋白质分子的二级结构起主要的作用,对维持三、四级结构亦有 一定的作用。 3.疏水作用力 两个或两个以上的疏水基团(非极性基团),由于周围的极 性水分子对它们的排斥,而被迫彼此接近,这时,由于范德华引力而互相结合, 这种结合力称为疏水作用力。有人称为疏水键。疏水键对维持蛋白质分子的三、 四级结构起主要作用。 4.离子键 离子键是指正离子与负离子之间的静电作用而形成的化学键。 离子键又称为盐键、盐桥。在一定条件下,蛋白质分子中的-NH3 +与-COOˉ可以形 成离子键。在一些蛋白质分子中,离子键参与维持三、四级结构。 5.配位键 两个原子之间的共价键,如果是由一个原子单独提供电子对而 形成的,此共价键就是配位键。在金属蛋白质分子中,如血红蛋白等,金属离子 与多肽链的连接,往往是配位键。配位键在一些蛋白质中参与维持三、四级结构。 6.二硫键 指两个硫原子之间的共价键,又称二硫桥、硫硫桥。在一些蛋
位。蛋白质四级结构是蛋白质亚基间次级键作用的结果。 蛋白质的一级结构是基础结构,而蛋白质的二、三、四级结构为高级结构, 即空间结构(构象)。蛋白质的功能表现依赖于空间结构的稳定。维持蛋白质空 间结构的作用力和键有以下几种类型(图 1- 4): 图 1-4 维持蛋白质分子构象的化学键 1.离子键 2.氢键 3.疏水键 4.范德华引力 5.二硫键 1.范德华引力 范德华引力的实质是静电引力。它包括三种力:(1)二个 极性基团偶极之间的静电吸引(取向力);(2)极性基团的偶极与非极性基团的 诱导偶极之间的静电吸引(诱导力);(3)二个非极性基团瞬时偶极之间的静电 吸引(色散力)。范德华引力参与维持蛋白质的三、四级结构。 2.氢键 与电负性较大、原子半径较小的 X 原子(如 N、O 等)共价结合 的氢原子,还可以与另一个电负性较大、半径较小的 Y 原子(如 N、O 等)结 合,所形成的第二个较弱的化学键,即为氢键。氢键一般指:X-H.Y,但亦有 人指:H.Y 之间的结合力。 氢键对维持蛋白质分子的二级结构起主要的作用,对维持三、四级结构亦有 一定的作用。 3.疏水作用力 两个或两个以上的疏水基团(非极性基团),由于周围的极 性水分子对它们的排斥,而被迫彼此接近,这时,由于范德华引力而互相结合, 这种结合力称为疏水作用力。有人称为疏水键。疏水键对维持蛋白质分子的三、 四级结构起主要作用。 4.离子键 离子键是指正离子与负离子之间的静电作用而形成的化学键。 离子键又称为盐键、盐桥。在一定条件下,蛋白质分子中的-NH3 +与-COOˉ可以形 成离子键。在一些蛋白质分子中,离子键参与维持三、四级结构。 5.配位键 两个原子之间的共价键,如果是由一个原子单独提供电子对而 形成的,此共价键就是配位键。在金属蛋白质分子中,如血红蛋白等,金属离子 与多肽链的连接,往往是配位键。配位键在一些蛋白质中参与维持三、四级结构。 6.二硫键 指两个硫原子之间的共价键,又称二硫桥、硫硫桥。在一些蛋

白质中,二硫键对稳定蛋白质分子构象起重要的作用。 二、蛋白质的变性 当蛋白质用酸、碱、浓盐溶液、有机溶剂、热、高压、激烈振荡和辐射处理 时,会不同程度地改变其构象。这个过程称为变性。从分子结构上看,变性作用 是多肽链特有的折叠结构发生的变化,成为无规卷曲或混乱伸展的结构,它仅涉 及蛋白质二、三、四级结构的变化,而并不包括一级结构肽链的破坏。也就是说, 变性时蛋白质中氢键、盐键和疏水作用等遭受到破坏,而肽键的共价键并未打断。 变性时蛋白质的性质也发生变化:(1)由于疏水基团大量暴露在分子表面,从而 降低了蛋白质的溶解度;(2)改变了对水的结合能力;(3)由于变性后的蛋白质 分子空间结构破坏,很难保持原有的生物活性;(4)发生絮集,形成不可逆的凝 胶;(5)由于肽键暴露,特别容易受到蛋白酶的攻击,从而提高对蛋白酶水解的 敏感性;(6)黏度增加;(7)不能形成结晶等。 天然蛋白质的变性可以是可逆或不可逆的。当变性因素解除以后,蛋白质恢 复原状的变化称为复性。如果变性时二硫键等较强的键合力被破坏,往往就不能 完全复性。 在食品加工和储藏中,有控制的和适度的蛋白质变性,可能有利于发挥蛋白 质的营养属性和功能性质;强烈的变性则会破坏蛋白质的功能性质,给食品的性 状带来不利。 (一)导致蛋白质变性的物理因素 加热:热是引起蛋白质变性最普通的物理因素,热变性是最常见的变性现象, 大多数蛋白质在 45~50 ℃已可察觉到变性,55 ℃左右变性进行得较快。在这 样不太高的温度下,蛋白质热变性仅仅涉及非共价键的变化,蛋白质分子变形伸 展的这种较短时间的变性为可逆变性。但在 70~80 ℃以上,蛋白质二硫键受热 而断裂的这种蛋白质在较高温度的长时间变性是不可逆变性。变性作用的速度取 决于温度的高低,在典型的变性作用范围内,温度每上升 10 ℃,速度可增加 600 倍左右。 蛋白质对热变性作用的敏感性取决于许多因素。例如,蛋白质的性质、浓度、 水分活度、pH、离子强度和离子种类等等。蛋白质、酶和微生物在干燥条件下 耐受热变性失活的能力比含水时更大,浓蛋白液受热变性后的复性更加困难。 干燥:蛋白质大量脱水,甚至用温和方法,例如冷冻干燥法脱水,仍然可引 起某些蛋白质的变性,这是由于蛋白质的保护性水化膜脱去,蛋白质互相靠近, 分子间相互作用所致。自然风干法脱水时,氧化反应会加大变性程度;喷雾干燥 法脱水时界面作用会加大变性程度;高温脱水中又难免热变性。 低温:低温能使某些蛋白质变性,如 L-苏氨酸脱氨酶在室温下稳定,而在 零度时不稳定。大豆球蛋白、麦醇溶蛋白、鸡蛋和牛乳蛋白冷却或冷冻时会发生 凝集和沉淀。但是有些脂酶和氧化酶不仅能耐受冷冻,而且在低温下能保持活性, 这是因为某些氧化酶因冷冻而能从细胞膜中释放出来而被激活。还应提及的是某 些植物和海洋动物可耐受低温,这是因为其蛋白质中具有较大比例的疏水性氨基 酸和依赖疏水相互作用的结构,因而在低温下能控制变性。但是这类蛋白质一般 在耐寒的植物和动物中并不存在。 机械处理:在加工面包或其他类型的食品面团时,因采用机械处理,如揉捏 或滚压,会由于产生剪切力而导致蛋白质变性。反复拉伸而导致 -螺旋的破坏
白质中,二硫键对稳定蛋白质分子构象起重要的作用。 二、蛋白质的变性 当蛋白质用酸、碱、浓盐溶液、有机溶剂、热、高压、激烈振荡和辐射处理 时,会不同程度地改变其构象。这个过程称为变性。从分子结构上看,变性作用 是多肽链特有的折叠结构发生的变化,成为无规卷曲或混乱伸展的结构,它仅涉 及蛋白质二、三、四级结构的变化,而并不包括一级结构肽链的破坏。也就是说, 变性时蛋白质中氢键、盐键和疏水作用等遭受到破坏,而肽键的共价键并未打断。 变性时蛋白质的性质也发生变化:(1)由于疏水基团大量暴露在分子表面,从而 降低了蛋白质的溶解度;(2)改变了对水的结合能力;(3)由于变性后的蛋白质 分子空间结构破坏,很难保持原有的生物活性;(4)发生絮集,形成不可逆的凝 胶;(5)由于肽键暴露,特别容易受到蛋白酶的攻击,从而提高对蛋白酶水解的 敏感性;(6)黏度增加;(7)不能形成结晶等。 天然蛋白质的变性可以是可逆或不可逆的。当变性因素解除以后,蛋白质恢 复原状的变化称为复性。如果变性时二硫键等较强的键合力被破坏,往往就不能 完全复性。 在食品加工和储藏中,有控制的和适度的蛋白质变性,可能有利于发挥蛋白 质的营养属性和功能性质;强烈的变性则会破坏蛋白质的功能性质,给食品的性 状带来不利。 (一)导致蛋白质变性的物理因素 加热:热是引起蛋白质变性最普通的物理因素,热变性是最常见的变性现象, 大多数蛋白质在 45~50 ℃已可察觉到变性,55 ℃左右变性进行得较快。在这 样不太高的温度下,蛋白质热变性仅仅涉及非共价键的变化,蛋白质分子变形伸 展的这种较短时间的变性为可逆变性。但在 70~80 ℃以上,蛋白质二硫键受热 而断裂的这种蛋白质在较高温度的长时间变性是不可逆变性。变性作用的速度取 决于温度的高低,在典型的变性作用范围内,温度每上升 10 ℃,速度可增加 600 倍左右。 蛋白质对热变性作用的敏感性取决于许多因素。例如,蛋白质的性质、浓度、 水分活度、pH、离子强度和离子种类等等。蛋白质、酶和微生物在干燥条件下 耐受热变性失活的能力比含水时更大,浓蛋白液受热变性后的复性更加困难。 干燥:蛋白质大量脱水,甚至用温和方法,例如冷冻干燥法脱水,仍然可引 起某些蛋白质的变性,这是由于蛋白质的保护性水化膜脱去,蛋白质互相靠近, 分子间相互作用所致。自然风干法脱水时,氧化反应会加大变性程度;喷雾干燥 法脱水时界面作用会加大变性程度;高温脱水中又难免热变性。 低温:低温能使某些蛋白质变性,如 L-苏氨酸脱氨酶在室温下稳定,而在 零度时不稳定。大豆球蛋白、麦醇溶蛋白、鸡蛋和牛乳蛋白冷却或冷冻时会发生 凝集和沉淀。但是有些脂酶和氧化酶不仅能耐受冷冻,而且在低温下能保持活性, 这是因为某些氧化酶因冷冻而能从细胞膜中释放出来而被激活。还应提及的是某 些植物和海洋动物可耐受低温,这是因为其蛋白质中具有较大比例的疏水性氨基 酸和依赖疏水相互作用的结构,因而在低温下能控制变性。但是这类蛋白质一般 在耐寒的植物和动物中并不存在。 机械处理:在加工面包或其他类型的食品面团时,因采用机械处理,如揉捏 或滚压,会由于产生剪切力而导致蛋白质变性。反复拉伸而导致 -螺旋的破坏

将致使蛋白质网络发生变化。 液压(流体静压):液压可以产生变性效应,但低于 50 kPa 时效果不明显。 卵清蛋白和胰蛋白酶分别在 50 kPa 和 60 kPa 时才表现出变性。 辐射:辐射对蛋白质的影响因波长和能量而变化,紫外辐射可被芳香族氨基 酸残基(色氨酸、酪氨酸和苯丙氨酸)所吸收,因而导致蛋白质构象改变。如果 能量水平非常高,则二硫键也会断裂。-辐射和其他电离辐射也可以使构象发生 变化,同时使氨基酸残基氧化、共价键断裂、电离、形成蛋白质自由基和发生重 组以及聚合反应,这些反应有许多是由水的辐解作用来传递的。 界面:凡在水和空气、水和非水溶液或水和固相等界面上吸附的蛋白质分子, 一般会发生不可逆变性。由于蛋白质可作为界面活性剂,许多蛋白质倾向于向界 面迁移及被吸附,吸附速率受天然蛋白质向界面扩散速率的控制。在分散系中, 水以不同能量水平存在:(1)远离界面的那些水分子处于低能态,它们不仅同其 他水分子,而且同蛋白质的离子和极性部位相互作用,(2)靠近界面的水分子处 于高能态,它们主要与其他水分子相互作用。蛋白质向界面扩散过程中,蛋白质 可能同高能量的水分子相互作用,许多蛋白质一蛋白质氢键可能同时遭到破坏, 并且发生结构的“微伸展”,因而许多疏水基团和水相接触,使部分伸展的蛋白 质更加不稳定,最后蛋白质在界面进一步伸展和扩展,亲水和疏水残基力图分别 在水溶液和非水相中取向,导致被吸附在界面上的蛋白质发生变性。 蛋白质在界面上的性质在各种食品体系中都是很重要的,如吸附在界面上的 蛋白质有助于乳浊液和泡沫的形成和稳定。但若欲保持蛋白质的天然构象和功能 性质,在加工或分离中应避免产生如泡沫或乳状液这样的分散系。 (二)导致蛋白质变性的化学因素 酸和碱:蛋白质所处介质的 pH 对变性过程有很大影响,大多数蛋白质在一 定 pH 范围内是稳定的,若与十分高或低的 pH 介质接触,则一般会发生变性。 因为在极端 pH 时,分子内离子基团会产生强烈的静电排斥,这将促使蛋白质分 子伸展(变性)。然而,在某些情况下,当 pH 调节到最初稳定范围时,蛋白质 可以恢复原有的结构。 金属:碱金属如 Na+和 K+仅有限度地与蛋白质起反应,而碱土金属如 Ca2+、 Mg2+则稍为活泼。过渡金属如 Cu2+、Fe2+、Hg2+和 Ag+等离子容易同蛋白质起作 用,能与其中的巯基形成稳定的络合物。Ca2+、Fe2+、Cu2+和 Mg2+可以成为某些 蛋白质分子中的一个组成部分。当用透析法或螯合剂将这些金属离子从蛋白质中 除出时,会明显降低蛋白质结构对热和蛋白酶作用的稳定性。 有机溶剂:大多数有机溶剂可用作蛋白质变性剂,除了降低溶剂(水)与蛋 白质的作用外,它们能改变介质的介电常数,从而改变了有助于蛋白质稳定的静 电作用力,非极性有机溶剂能够渗入疏水区,破坏疏水相互作用,因而促使蛋白 质变性。这类溶剂的变性作用也可能是它们同水彼此间产生的相互作用而引起 的。2-氯乙醇能使 -螺旋构象占优势,这种作用也可认为是一种变性,例如卵 清蛋白在水溶液介质中有 31%的 -螺旋,而在 2-氯乙醇中为 85%。 有机化合物:脲素或胍盐当配制成高浓度(4~8 mol/L)水溶液时,会导致 氢键的断裂,并引起蛋白质不同程度的变性。这些化合物还通过增加疏水氨基酸 残基在水溶液中的溶解度而降低疏水的相互作用。表面活性剂如十二烷基硫酸钠 也是很强的变性剂,这类化合物在蛋白质疏水区和亲水环境之间起着媒介作用。 因此,它们除能破坏疏水相互作用外,还有利于天然蛋白质的伸展。还原剂(半 胱氨酸、抗坏血酸、-巯基乙醇、二硫苏糖醇)可使二硫键还原,因而改变蛋白
将致使蛋白质网络发生变化。 液压(流体静压):液压可以产生变性效应,但低于 50 kPa 时效果不明显。 卵清蛋白和胰蛋白酶分别在 50 kPa 和 60 kPa 时才表现出变性。 辐射:辐射对蛋白质的影响因波长和能量而变化,紫外辐射可被芳香族氨基 酸残基(色氨酸、酪氨酸和苯丙氨酸)所吸收,因而导致蛋白质构象改变。如果 能量水平非常高,则二硫键也会断裂。-辐射和其他电离辐射也可以使构象发生 变化,同时使氨基酸残基氧化、共价键断裂、电离、形成蛋白质自由基和发生重 组以及聚合反应,这些反应有许多是由水的辐解作用来传递的。 界面:凡在水和空气、水和非水溶液或水和固相等界面上吸附的蛋白质分子, 一般会发生不可逆变性。由于蛋白质可作为界面活性剂,许多蛋白质倾向于向界 面迁移及被吸附,吸附速率受天然蛋白质向界面扩散速率的控制。在分散系中, 水以不同能量水平存在:(1)远离界面的那些水分子处于低能态,它们不仅同其 他水分子,而且同蛋白质的离子和极性部位相互作用,(2)靠近界面的水分子处 于高能态,它们主要与其他水分子相互作用。蛋白质向界面扩散过程中,蛋白质 可能同高能量的水分子相互作用,许多蛋白质一蛋白质氢键可能同时遭到破坏, 并且发生结构的“微伸展”,因而许多疏水基团和水相接触,使部分伸展的蛋白 质更加不稳定,最后蛋白质在界面进一步伸展和扩展,亲水和疏水残基力图分别 在水溶液和非水相中取向,导致被吸附在界面上的蛋白质发生变性。 蛋白质在界面上的性质在各种食品体系中都是很重要的,如吸附在界面上的 蛋白质有助于乳浊液和泡沫的形成和稳定。但若欲保持蛋白质的天然构象和功能 性质,在加工或分离中应避免产生如泡沫或乳状液这样的分散系。 (二)导致蛋白质变性的化学因素 酸和碱:蛋白质所处介质的 pH 对变性过程有很大影响,大多数蛋白质在一 定 pH 范围内是稳定的,若与十分高或低的 pH 介质接触,则一般会发生变性。 因为在极端 pH 时,分子内离子基团会产生强烈的静电排斥,这将促使蛋白质分 子伸展(变性)。然而,在某些情况下,当 pH 调节到最初稳定范围时,蛋白质 可以恢复原有的结构。 金属:碱金属如 Na+和 K+仅有限度地与蛋白质起反应,而碱土金属如 Ca2+、 Mg2+则稍为活泼。过渡金属如 Cu2+、Fe2+、Hg2+和 Ag+等离子容易同蛋白质起作 用,能与其中的巯基形成稳定的络合物。Ca2+、Fe2+、Cu2+和 Mg2+可以成为某些 蛋白质分子中的一个组成部分。当用透析法或螯合剂将这些金属离子从蛋白质中 除出时,会明显降低蛋白质结构对热和蛋白酶作用的稳定性。 有机溶剂:大多数有机溶剂可用作蛋白质变性剂,除了降低溶剂(水)与蛋 白质的作用外,它们能改变介质的介电常数,从而改变了有助于蛋白质稳定的静 电作用力,非极性有机溶剂能够渗入疏水区,破坏疏水相互作用,因而促使蛋白 质变性。这类溶剂的变性作用也可能是它们同水彼此间产生的相互作用而引起 的。2-氯乙醇能使 -螺旋构象占优势,这种作用也可认为是一种变性,例如卵 清蛋白在水溶液介质中有 31%的 -螺旋,而在 2-氯乙醇中为 85%。 有机化合物:脲素或胍盐当配制成高浓度(4~8 mol/L)水溶液时,会导致 氢键的断裂,并引起蛋白质不同程度的变性。这些化合物还通过增加疏水氨基酸 残基在水溶液中的溶解度而降低疏水的相互作用。表面活性剂如十二烷基硫酸钠 也是很强的变性剂,这类化合物在蛋白质疏水区和亲水环境之间起着媒介作用。 因此,它们除能破坏疏水相互作用外,还有利于天然蛋白质的伸展。还原剂(半 胱氨酸、抗坏血酸、-巯基乙醇、二硫苏糖醇)可使二硫键还原,因而改变蛋白

质的构象。 三、食品蛋白质的功能性质 食品蛋白质的功能性质是指蛋白质对食品产生必要特征的那些物理、化学性 质。食品蛋白质的功能性质分为三大类:(1)水合性质,包括水的吸收和保持、 湿润性、溶胀性、黏附性、分散性、溶解度和黏度等,这一类性质主要取决于蛋 白质−水的相互作用;(2)蛋白质−蛋白质相互作用的有关性质,包括沉淀、胶凝 和形成其他各种结构时起作用的性质;(3)表面性质,包括蛋白质的表面张力、 乳化作用和蛋白质的发泡性等。这些性质之间不是绝然分开的,是互相关联的。 例如,黏度和溶解度取决于蛋白质−水和蛋白质−蛋白质的相互作用;凝胶作用不 仅包括蛋白质−蛋白质相互作用,而且还有蛋白质−水相互作用。 (一)水合性质 蛋白质在溶液中的构象主要取决于它和水之间的相互作用。大多数食品是水 合固态体系。食品中的蛋白质和其他成分的物理化学及流变学性质,不仅受到体 系中水的强烈影响,而且还受到水活性的影响。 蛋白质从干燥状态开始逐渐水合涉及 5 个步骤(图 1-5): 图 1-5 干蛋白质的蛋白质-水相互作用步骤 蛋白质制品的许多功能性与水合作用有关。例如水吸收作用(也叫水摄取、 亲和性或结合性)、溶胀、润湿性、持水容量(或水保留作用),以及黏附和内聚 力都与水合作用的前 4 个步骤有关;分散性和黏度(或增稠力)涉及第 5 个步骤; 蛋白质的最终状态,可溶性或不溶性(部分或全部)也与功能性质(例如溶解性 或速溶性)有关。胶凝作用是指充分水合的不溶性块状物的形成,而且要求产生 特殊的蛋白质-蛋白质相互作用;与表面性质有关的功能性,例如乳化作用和发 泡性,蛋白质还必须是高度水合和分散的。 蛋白质的水合性质是食品化学上的重要性质。例如当向肉制品、面包或干酪 等食品中添加大豆蛋白时,蛋白质的吸水性便成为一个重要因素。即使加热也能 保持水分,这对肉制品来说是至关重要的,因为只有保持肉汁,肉制品才能有良 好的口感和风味。 1.影响蛋白质水合性质的因素 (1)浓度 水的总吸收率随蛋白质浓度的增大而增加。 (2)pH pH 的变化影响蛋白质分子的解离和净电荷量,因而可影响蛋白质 −蛋白质、蛋白质水相互作用力。在等电点 pH 时,蛋白质蛋白质相互作用最强, 蛋白质的水合作用和溶胀最小。例如宰后僵直前的生牛肉(或牛肉匀浆)pH 从 6.5 下降至近 5.0(等电点),其持水容量显著减小(图 1-6),并导致肉的汁液减 少和嫩度降低。 干蛋 白质 ① 通过极性位点 结合吸附水分子 ② 多分子层 水吸附 ③ 液体水 凝聚 ④ 溶胀 溶剂化 分散作用 ⑤ 溶胀的不溶性 颗粒或块状物 溶液
质的构象。 三、食品蛋白质的功能性质 食品蛋白质的功能性质是指蛋白质对食品产生必要特征的那些物理、化学性 质。食品蛋白质的功能性质分为三大类:(1)水合性质,包括水的吸收和保持、 湿润性、溶胀性、黏附性、分散性、溶解度和黏度等,这一类性质主要取决于蛋 白质−水的相互作用;(2)蛋白质−蛋白质相互作用的有关性质,包括沉淀、胶凝 和形成其他各种结构时起作用的性质;(3)表面性质,包括蛋白质的表面张力、 乳化作用和蛋白质的发泡性等。这些性质之间不是绝然分开的,是互相关联的。 例如,黏度和溶解度取决于蛋白质−水和蛋白质−蛋白质的相互作用;凝胶作用不 仅包括蛋白质−蛋白质相互作用,而且还有蛋白质−水相互作用。 (一)水合性质 蛋白质在溶液中的构象主要取决于它和水之间的相互作用。大多数食品是水 合固态体系。食品中的蛋白质和其他成分的物理化学及流变学性质,不仅受到体 系中水的强烈影响,而且还受到水活性的影响。 蛋白质从干燥状态开始逐渐水合涉及 5 个步骤(图 1-5): 图 1-5 干蛋白质的蛋白质-水相互作用步骤 蛋白质制品的许多功能性与水合作用有关。例如水吸收作用(也叫水摄取、 亲和性或结合性)、溶胀、润湿性、持水容量(或水保留作用),以及黏附和内聚 力都与水合作用的前 4 个步骤有关;分散性和黏度(或增稠力)涉及第 5 个步骤; 蛋白质的最终状态,可溶性或不溶性(部分或全部)也与功能性质(例如溶解性 或速溶性)有关。胶凝作用是指充分水合的不溶性块状物的形成,而且要求产生 特殊的蛋白质-蛋白质相互作用;与表面性质有关的功能性,例如乳化作用和发 泡性,蛋白质还必须是高度水合和分散的。 蛋白质的水合性质是食品化学上的重要性质。例如当向肉制品、面包或干酪 等食品中添加大豆蛋白时,蛋白质的吸水性便成为一个重要因素。即使加热也能 保持水分,这对肉制品来说是至关重要的,因为只有保持肉汁,肉制品才能有良 好的口感和风味。 1.影响蛋白质水合性质的因素 (1)浓度 水的总吸收率随蛋白质浓度的增大而增加。 (2)pH pH 的变化影响蛋白质分子的解离和净电荷量,因而可影响蛋白质 −蛋白质、蛋白质水相互作用力。在等电点 pH 时,蛋白质蛋白质相互作用最强, 蛋白质的水合作用和溶胀最小。例如宰后僵直前的生牛肉(或牛肉匀浆)pH 从 6.5 下降至近 5.0(等电点),其持水容量显著减小(图 1-6),并导致肉的汁液减 少和嫩度降低。 干蛋 白质 ① 通过极性位点 结合吸附水分子 ② 多分子层 水吸附 ③ 液体水 凝聚 ④ 溶胀 溶剂化 分散作用 ⑤ 溶胀的不溶性 颗粒或块状物 溶液