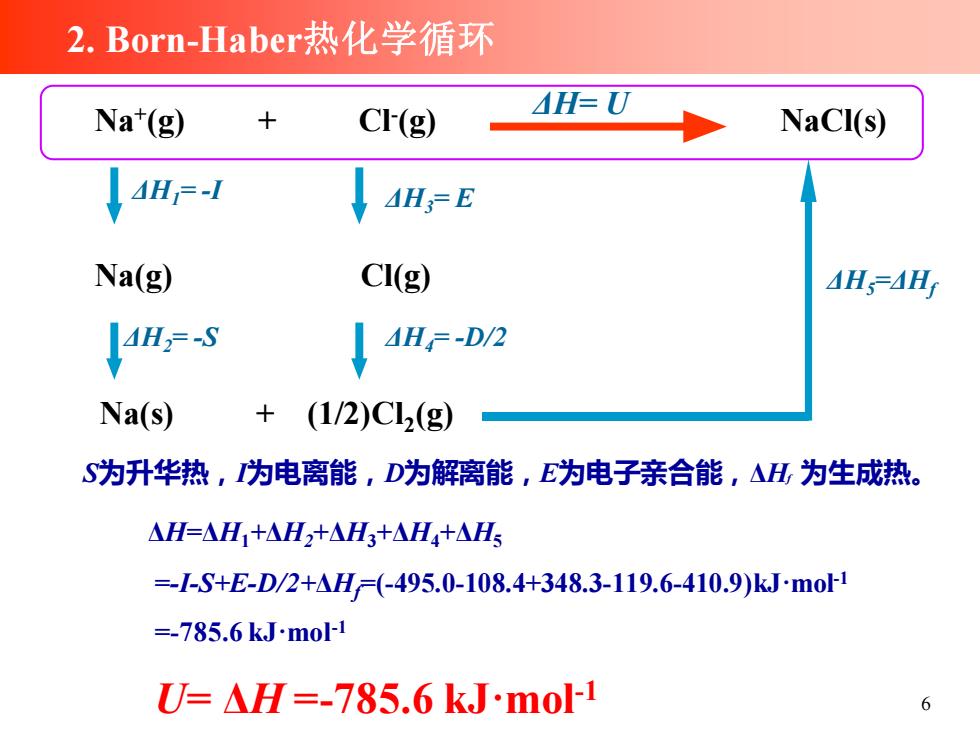
2.Born-Haber热化学循环 Na*(g) CI(g) H=U NaCI(s) 4H=-I AH;=E Na(g) CI(g) AHS=AH 4H2=-S AH=-D/2 Na(s) (1/2)C12(g) S为升华热,为电离能,D为解离能,E为电子亲合能,△H为生成热。 △H=△H1+△H2+△H3+△H4+△HS =-S+E-D/2+H=(-495.0-108.4+348.3-119.6-410.9)kJmo1 =-785.6kJmo1 U=H=-785.6kJmo1 6
6 ΔH=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5 =-I-S+E-D/2+ΔHf=(-495.0-108.4+348.3-119.6-410.9)kJ·mol-1 =-785.6 kJ·mol-1 U= ΔH =-785.6 kJ·mol-1 ΔH= U ΔH5=ΔHf ΔH4= -D/2 ΔH3= E ΔH2= -S ΔH1= -I Na+ (g) + Cl- (g) NaCl(s) Na(g) Cl(g) Na(s) + (1/2)Cl2 (g) 2. Born-Haber热化学循环 S为升华热,I为电离能,D为解离能,E为电子亲合能,ΔHf 为生成热

第10章离子晶体的结构 理论计算结果: U=-753 kJmol-1 静电作用力 实验测定结果: U=AH=-785.6 kJmol-1 离子晶体的晶格能的实验测定结果与静电模型计算结果相符合 结论: 离子键的静电模型是正确的
U= -753 kJ·mol-1 第10章 离子晶体的结构 U= ΔH =-785.6 kJ·mol-1 理论计算结果: 静电作用力 实验测定结果: 离子晶体的晶格能的实验测定结果与静电模型计算结果相符合 结论: 离子键的静电模型是正确的

第10章离子晶体的结构 7.4离子晶体的一些典型结构 7.4.1离子半径 离子可近似地看作具有一定半径的弹性球。同 号离子相互排斥。异号离子虽然相互吸引,但也只 能接近到一定距离,因为正负离子都有电子云,具 有近程排斥作用。这个距离就是离子键的平衡键长。 核间的平衡距离等于两个互相接触的球形离子 的半径之和,但如何划分成正负离子半径则有几种 不同的方案。此外,离子半径的数值也与所处的环 境有关,并非一成不变
8 离子可近似地看作具有一定半径的弹性球。同 号离子相互排斥。异号离子虽然相互吸引,但也只 能接近到一定距离,因为正负离子都有电子云,具 有近程排斥作用。这个距离就是离子键的平衡键长。 7.4 离子晶体的一些典型结构 第10章 离子晶体的结构 核间的平衡距离等于两个互相接触的球形离子 的半径之和,但如何划分成正负离子半径则有几种 不同的方案。此外,离子半径的数值也与所处的环 境有关,并非一成不变。 7.4.1 离子半径
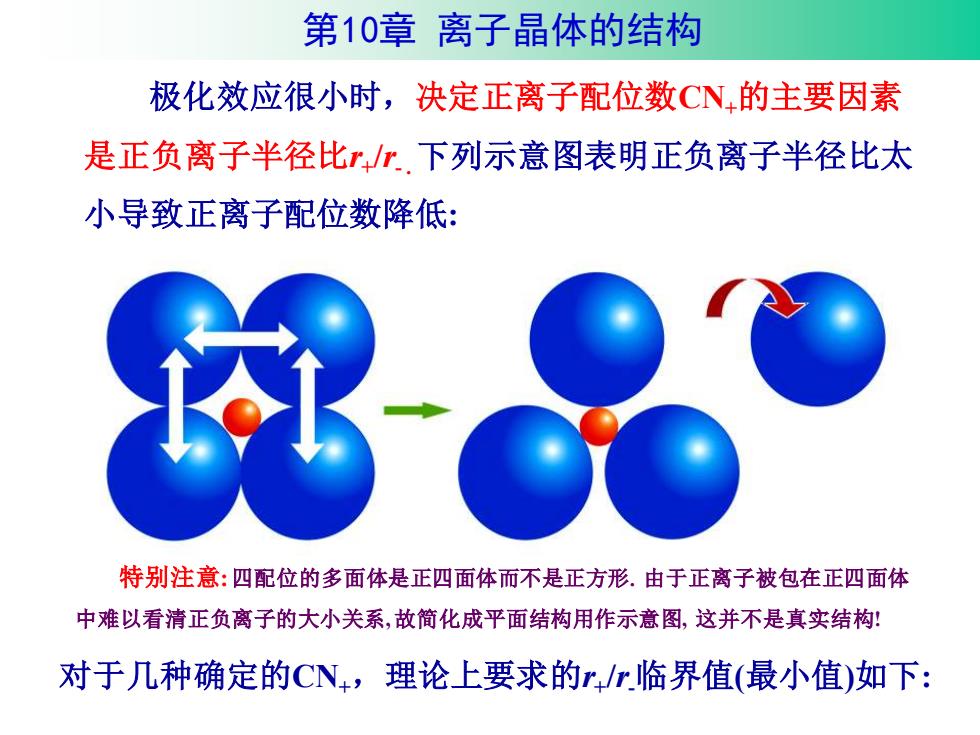
第10章离子晶体的结构 极化效应很小时,决定正离子配位数CN的主要因素 是正负离子半径比r/r.下列示意图表明正负离子半径比太 小导致正离子配位数降低: 特别注意:四配位的多面体是正四面体而不是正方形.由于正离子被包在正四面体 中难以看清正负离子的大小关系,故简化成平面结构用作示意图,这并不是真实结构: 对于几种确定的CN,理论上要求的r/r临界值(最小值)如下:
极化效应很小时,决定正离子配位数CN+的主要因素 是正负离子半径比r+ /r- .下列示意图表明正负离子半径比太 小导致正离子配位数降低: 对于几种确定的CN+,理论上要求的r+ /r-临界值(最小值)如下: 特别注意:四配位的多面体是正四面体而不是正方形. 由于正离子被包在正四面体 中难以看清正负离子的大小关系, 故简化成平面结构用作示意图, 这并不是真实结构! 第10章 离子晶体的结构

第10章离子晶体的结构 7.4.2 离子半径比与配位数的关系 离子键没有方向 性和饱和性。所以, 离子晶体结构也可 用非等径圆球堆积 来描述. 通常,较大的负离 子形成等径圆球密堆 积,正离子填在空隙中. 10
10 离子键没有方向 性和饱和性. 所以, 离子晶体结构也可 用非等径圆球堆积 来描述. 7.4.2 离子半径比与配位数的关系 第10章 离子晶体的结构 通常, 较大的负离 子形成等径圆球密堆 积, 正离子填在空隙中