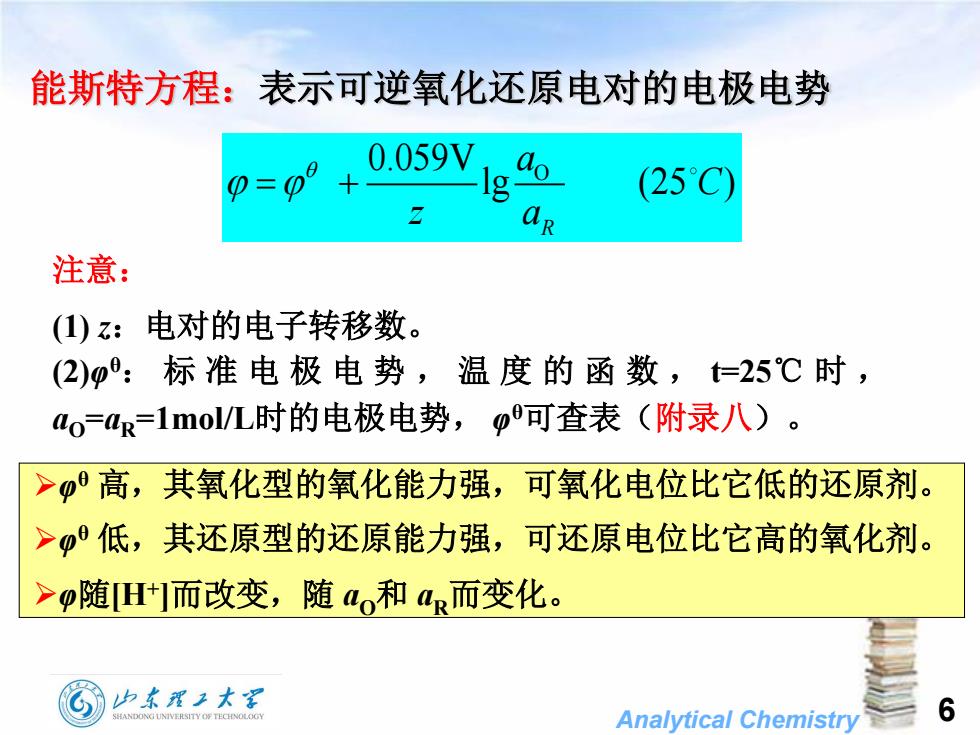
能斯特方程:表示可逆氧化还原电对的电极电势 0.059V 0=0°+ (25C) 注意: (1)z: 电对的电子转移数。 (2):标准电极电势,温度的函数,t=25℃时, ao=a=1mol/L时的电极电势,p可查表(附录八)。 >高,其氧化型的氧化能力强,可氧化电位比它低的还原剂。 >低,其还原型的还原能力强,可还原电位比它高的氧化剂。 >p随H而改变,随ao和a而变化。 山东理工大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 6
Analytical Chemistry (1) z:电对的电子转移数。 (2)φ θ: 标 准 电 极 电 势 , 温 度 的 函 数 , t=25℃ 时 , aO =aR =1mol/L时的电极电势, φ θ可查表(附录八)。 φ θ 高,其氧化型的氧化能力强,可氧化电位比它低的还原剂。 φ θ 低,其还原型的还原能力强,可还原电位比它高的氧化剂。 φ随[H+ ]而改变,随 aO和 aR而变化。 注意: 能斯特方程:表示可逆氧化还原电对的电极电势 O 0.059V lg (25 ) R a C z a 6
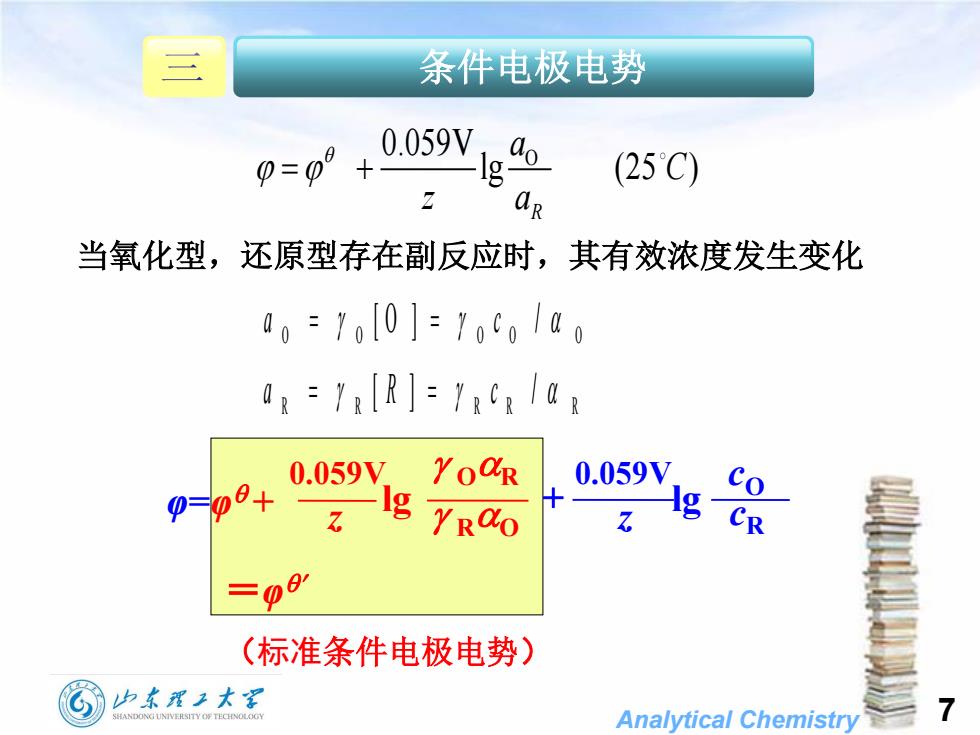
三 条件电极电势 0=0 0.059V o g (25C) aR 当氧化型,还原型存在副反应时,其有效浓度发生变化 00=1o0]=yo0oa0 0,=1:[R]=Ya 0.059V.YoaR 0.059V 0=08+ g YRdO g CR (标准条件电极电势) G 山东理子大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry
Analytical Chemistry O 0.059V lg (25 ) R a C z a 当氧化型,还原型存在副反应时,其有效浓度发生变化 =φ (标准条件电极电势) 0.059V lg 0.059V lg z cO z φ=φ + OR RO cR 条件电极电势 O O O O O a c [ O ] / R R R R R a R c [ ] / 7
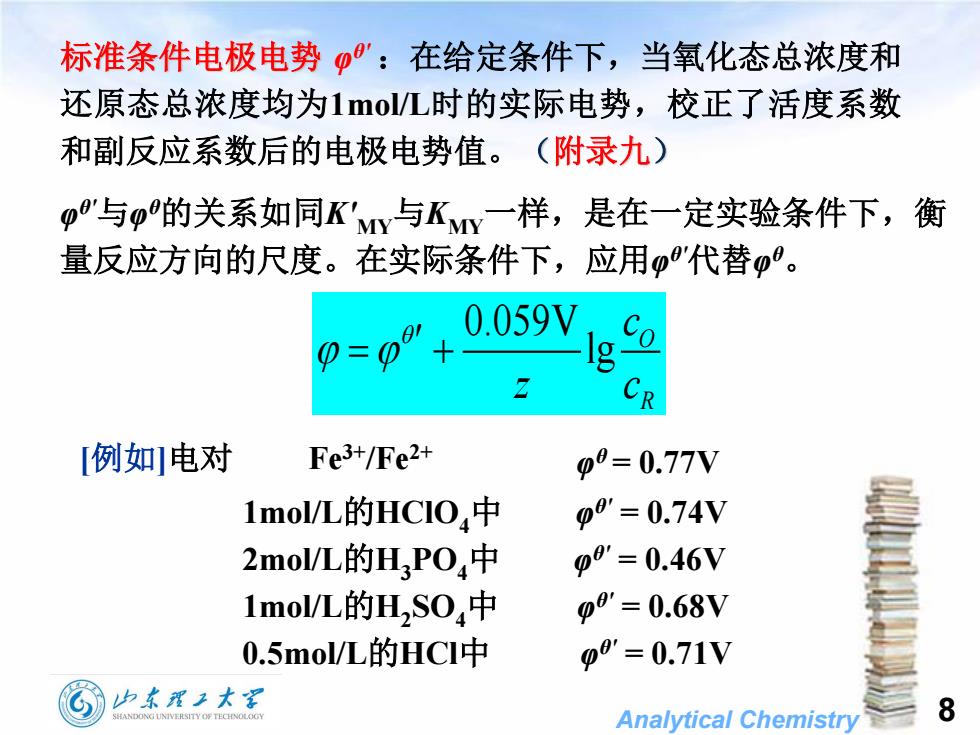
标准条件电极电势':在给定条件下,当氧化态总浓度和 还原态总浓度均为1o/L时的实际电势,校正了活度系数 和副反应系数后的电极电势值。(附录九) "与的关系如同Ky与KMY一样,是在一定实验条件下,衡 量反应方向的尺度。在实际条件下,应用o8'代替0。 0.059V 0=0 CR [例如电对 Fe3+/Fe2+ p0=0.77V 1mol/L的HC1O,中 00'=0.74V 2mol/L的HPO4中 p8'=0.46V 1mol/L的HS0,中 0p8'=0.68V 0.5mol/L的HCl中 p8'=0.71V 山东理工大军 SHANDONG UNIVERSITY OF TECHNOLOGY Analytical Chemistry 8
Analytical Chemistry 0.059V lg O R c z c 标准条件电极电势 φ θ' :在给定条件下,当氧化态总浓度和 还原态总浓度均为1mol/L时的实际电势,校正了活度系数 和副反应系数后的电极电势值。(附录九) φ θ'与φ θ的关系如同K'MY与KMY一样,是在一定实验条件下,衡 量反应方向的尺度。在实际条件下,应用φ θ'代替φ θ 。 [例如]电对 Fe3+/Fe2+ φ θ = 0.77V 1mol/L的HClO4中 φ θ' = 0.74V 2mol/L的H3PO4中 φ θ' = 0.46V 1mol/L的H2 SO4中 φ θ' = 0.68V 0.5mol/L的HCl中 φ θ' = 0.71V 8

例计算1mol/LHCI溶液中,c(Ce4+)=1.00×102mol/L, c(Ce3+)=1.00x103mol/L时,Ce4+/Ce3+电对的电势。 解 0.059y1g 查条件电势表1mol/LHC1溶液中,o9'=1.28V =o"+0.059V1g ce(IV) 1 ce( =1.28V+0.059V1g100×10 1.00×102 =1.34V 山东覆王大军 Analytical Chemistry 9
Analytical Chemistry 9 例 计算1 mol/L HCl 溶液中,c(Ce4+) = 1.0010-2 mol/L, c(Ce3+) = 1.0010-3 mol/L时, Ce4+ / Ce3+电对的电势。 解 查条件电势表 1 mol/L HCl 溶液中, φ ´=1.28V (IV) (III) 0.059V lg 1 Ce Ce c c 2 3 1.00 10 1.28V 0.059Vlg 1.00 10 1.34V 0.059V lg O R c z c
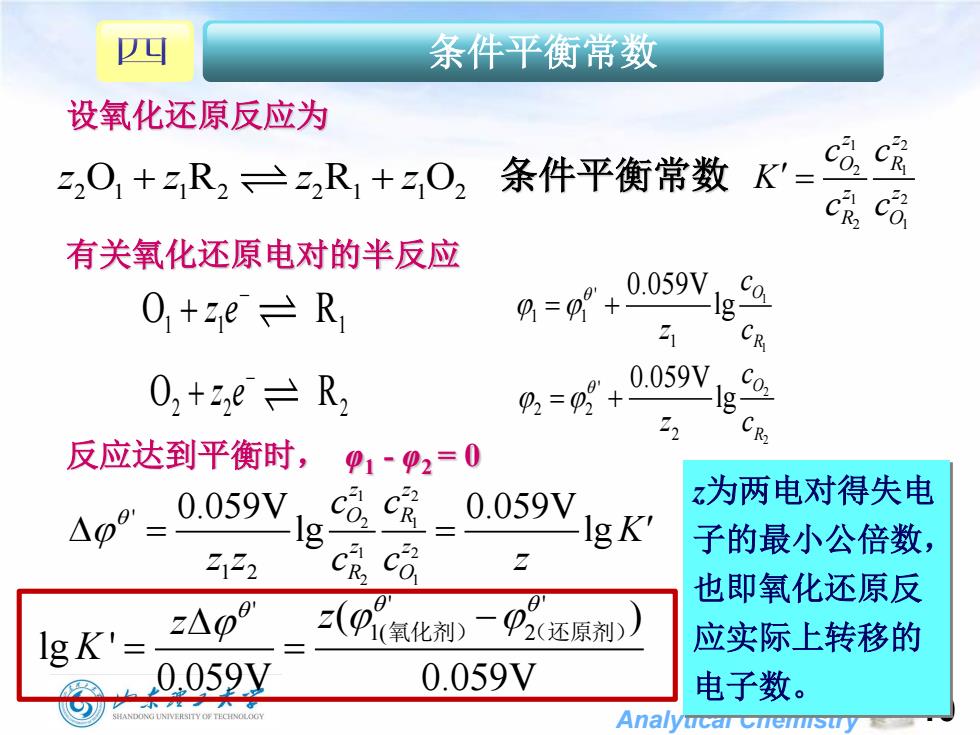
四 条件平衡常数 设氧化还原反应为 2201+R222R1+z02 条件平衡常数 有关氧化还原电对的半反应 O+zeR 0059Ng 21 0,+2,e=R, g+ 0.059V, C 反应达到平衡时, 41-92=0 0.059V, 0.059V z为两电对得失电 g Ig K' 子的最小公倍数, 2122 也即氧化还原反 IgK'= EA0O z(p领化刹)二 2(还原剂) 应实际上转移的 0059y 0.059V 电子数。 SHANDONG UNIVERSITY OF TECHNOLOGY Analytcar cnemstry
Analytical Chemistry ' ' ' 1( 2 ( ) lg ' 0.059V 0.059V z z K 氧化剂) (还原剂) 10 设氧化还原反应为 有关氧化还原电对的半反应 1 1 ' 1 1 1 0.059V lg O R c z c 2 2 ' 2 2 2 0.059V lg O R c z c 反应达到平衡时, φ1 - φ2 = 0 z为两电对得失电 子的最小公倍数, 也即氧化还原反 应实际上转移的 电子数。 条件平衡常数 z z z z 2 1 1 2 2 1 1 2 O R R O 条件平衡常数 O R 1 1 1 z e O R 2 2 2 z e 1 2 2 1 1 2 2 1 z z O R z z R O c c K c c 1 2 2 1 1 2 2 1 ' 1 2 0.059V 0.059V lg lg z z O R z z R O c c K' z z c c z