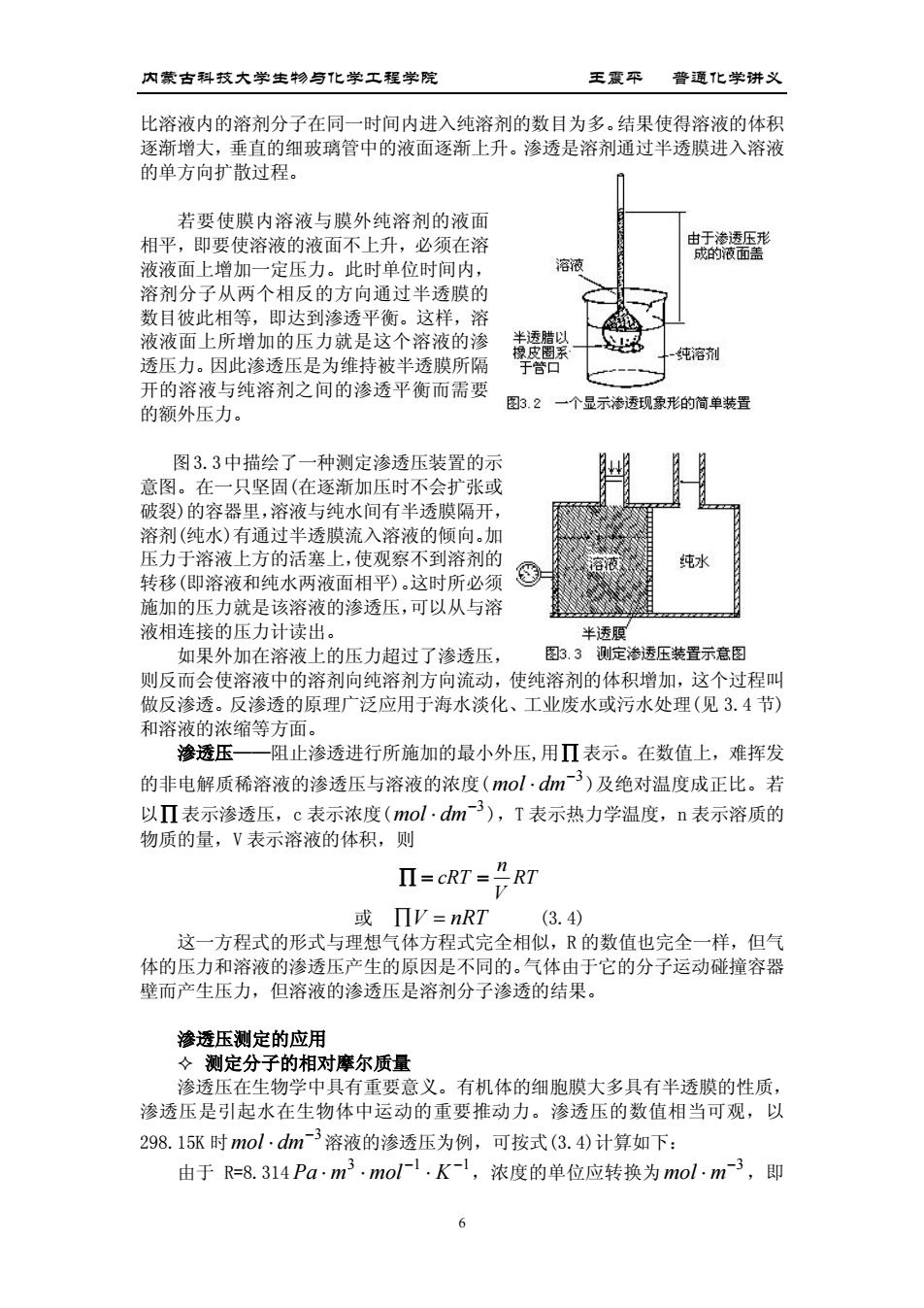
内蒙古科技大学生身化学工程学院 王霞平普通化学讲义 比溶液内的溶剂分子在同一时间内进入纯溶剂的数目为多。结果使得溶液的体积 逐渐增大,垂直的细玻璃管中的液面逐渐上升。渗透是溶剂通过半透膜进入溶液 的单方向扩散过程 若要使膜内溶液与膜外纯溶剂的液面 相平,即要使溶液的液面不上升,必须在溶 液液面上增加一定压力。此时单位时间内 溶液 溶剂分子从两个相反的方向通过半透膜的 数目彼此相等 即达到渗透 平衡。这样 液液面上所增加的压力就是这个溶液的渗 -纯溶剂 透压力。因此渗透压是为维持被半透膜所隔 开的溶液与纯溶剂之间的渗透平衡而需要 的领外压力。 图3.2一个显示渗透现象形的简单装置 图3.3中描绘了 ·种测定渗透压装置的示 意图。在一只坚固(在逐渐加压时不会扩张或 破裂)的容器里,溶液与纯水间有半透膜隔开, 溶剂(纯水)有通过半透膜流入溶液的倾向。加 压力于溶液上方的活塞上,使观察不到溶剂的 纯 转移(即 溶液和纯水两液面相平)。这时所 施加的压力就是该溶液的渗透压,可以从与溶 液相连接的压力计读出。 半诱 如果外加在溶液上的压力超过了渗透压, 图3.3测定渗透压装置示意图 则反而会使溶液中的溶剂向纯溶剂方向流动,使纯溶剂的体积增加,这个过程叫 做反渗透。 反渗透的原理广泛应用于海水淡化、工业废水或污水处理(见3.4节) 和溶液的浓缩等方面。 渗透压一 一阻止渗透进行所施加的最小外压,用Π表示。在数值上,难挥发 的非电解质稀溶液的渗透压与溶液的浓度(m0l·dm3)及绝对温度成正比。若 以Π表示渗透压,c表示浓度(mol·dm3),T表示热力学温度,n表示溶质的 物质的量,V表示溶液的体积,则 II-cRT-"RT 或ΠV=nRT (3.4) 这一方程式的形式与理想气体方程式完全相似,R的数值也完全一样,但气 体的压力和溶液的渗透压产生的原因是不同的。气体由于它的分子运动碰撞容器 壁而产生压力,但溶液的渗透压是溶剂分子渗透的结果。 渗透压测定的应用 ◇测定分子的相对摩尔质量 渗透压在生物学中具有重要意义。有机体的细胞膜大多具有半透膜的性质, 渗透压是引起水在生物体中运动的重要推动力。渗透压的数值相当可观,以 298.15K时mol·d3溶液的渗透压为例,可按式(3.4)计算如下: 由于R=8.314Pa·m3.mo1.K-1,浓度的单位应转换为mol·m3,,即 6
内蒙古科技大学生物与化学工程学院 王震平 普通化学讲义 6 比溶液内的溶剂分子在同一时间内进入纯溶剂的数目为多。结果使得溶液的体积 逐渐增大,垂直的细玻璃管中的液面逐渐上升。渗透是溶剂通过半透膜进入溶液 的单方向扩散过程。 若要使膜内溶液与膜外纯溶剂的液面 相平,即要使溶液的液面不上升,必须在溶 液液面上增加一定压力。此时单位时间内, 溶剂分子从两个相反的方向通过半透膜的 数目彼此相等,即达到渗透平衡。这样,溶 液液面上所增加的压力就是这个溶液的渗 透压力。因此渗透压是为维持被半透膜所隔 开的溶液与纯溶剂之间的渗透平衡而需要 的额外压力。 图3.3中描绘了一种测定渗透压装置的示 意图。在一只坚固(在逐渐加压时不会扩张或 破裂)的容器里,溶液与纯水间有半透膜隔开, 溶剂(纯水)有通过半透膜流入溶液的倾向。加 压力于溶液上方的活塞上,使观察不到溶剂的 转移(即溶液和纯水两液面相平)。这时所必须 施加的压力就是该溶液的渗透压,可以从与溶 液相连接的压力计读出。 如果外加在溶液上的压力超过了渗透压, 则反而会使溶液中的溶剂向纯溶剂方向流动,使纯溶剂的体积增加,这个过程叫 做反渗透。反渗透的原理广泛应用于海水淡化、工业废水或污水处理(见 3.4 节) 和溶液的浓缩等方面。 渗透压——阻止渗透进行所施加的最小外压,用 表示。在数值上,难挥发 的非电解质稀溶液的渗透压与溶液的浓度( 3 mol dm )及绝对温度成正比。若 以 表示渗透压,c 表示浓度( 3 mol dm ),T 表示热力学温度,n 表示溶质的 物质的量,V 表示溶液的体积,则 RT V n cRT 或 V nRT (3.4) 这一方程式的形式与理想气体方程式完全相似,R 的数值也完全一样,但气 体的压力和溶液的渗透压产生的原因是不同的。气体由于它的分子运动碰撞容器 壁而产生压力,但溶液的渗透压是溶剂分子渗透的结果。 渗透压测定的应用 测定分子的相对摩尔质量 渗透压在生物学中具有重要意义。有机体的细胞膜大多具有半透膜的性质, 渗透压是引起水在生物体中运动的重要推动力。渗透压的数值相当可观,以 298.15K 时 3 mol dm 溶液的渗透压为例,可按式(3.4)计算如下: 由于 R=8.314 3 1 1 Pa m mol K ,浓度的单位应转换为 3 mol m ,即

内聚古科技大学生物与化学工程学院 王震平普通化学讲义 c=0.100 mol.dm3=0.100×10molm3,所以 Π=cRT =0.100×103mol·m-3×8.314Pam3.mol1.K-l×298 =248kPa 一般植物细胞汁的渗透压约可达2000kP,所以水分可以从植物的根部运送 到数十米高的顶端。 人体血液的渗透压约为780kPa,病人注射或输液时,使用0.9%的NaC溶 液(0.16mol·dm3)或5%的葡萄糖溶液(0.28mol·dm3),这两种溶液与红 细胞和血浆都是等渗溶液(即渗透压相等)。 人体血液平均 压约为780kPe 由于人体有保持渗透压在正常范围的 要求,因此,对人体注射或静脉输液时,应使用渗透压与人体内的基本相等的溶 液,在生物学和医学上这种溶液称为等渗溶液,例如临床常用的是质量分数5.0 %(0.28mol·dm3)葡萄糖溶液,否则由于渗透作用,可产生严重后果①。如 果把血红细胞放入渗透压较大(与正常血液的相比)的溶液中,血红细胞中的水就 会通过细胞膜渗透出来,甚至能引起血红细胞收缩并从悬浮状态中沉降下来;如 果把这种细胞放入渗透压较小的溶液中,血液中的水就会通过血红细胞的膜流入 细胞中,而使细胞膨胀,甚至能使细胞膜破裂。 反渗透 若外加在溶液上的压力大于渗透压,则会使溶液中的溶剂向纯溶剂方向流 动,使纯溶剂体积增加,该过程叫反渗透。广泛用于海水淡化、工业废水的处理 及溶液的浓缩等,关键在于耐高压半透膜的制备。 3.12 由翠质的通性 可仑尼乌斯根据电解质溶液不服从稀溶液定律的现象,提出了电离理论 1903年他获得了诺贝尔化学奖。电离理论认为电解质分子在水溶液中解离成离 子,使得溶液中的微粒数增大,故它们的蒸汽压、沸点、熔点的改变和渗透压数 值都比非电解质大。 解离度 一溶液中己解离的电解质的分子数与电解质总分子数之比。 解离度α=已解离的电解质浓度 100% 由解质的起始浓度 在日常生活中可见到如海水不 结冰 其凝固点低于273.15K 而沸点则 高于373.15K。又如,工业上或实验室中常采用某些易潮解的固态物质,如氯化 钙、五氧化二磷等作为干燥剂,就是因为这些物质能使其表面所形成的溶液的蒸 气压力显著下降,当它低于空气中水蒸气的分压时,空气中水蒸气可不断凝聚而 讲入容液,即这些物质能不断地吸收水菱气。若在密闭容器内,则可讲行到空气 的分压等于这些物质的(饱和)溶液的蒸气压为 再如,利用溶液凝周点下降这一性质,盐和冰的混合物可以作为冷冻剂。冰 的表面上有少量水,当盐与冰混合时,盐溶解在这些水里成为溶液。此时,由于 所生成的溶液中水的蒸气压力低于冰的蒸气压力,冰就融化。冰融化时要吸收熔 化热,使周围物质的温度降低。例如,采用氯化钠和冰的混合物,温度可以降低 可以降低到218K。在金属表面处理(见6.3 >
内蒙古科技大学生物与化学工程学院 王震平 普通化学讲义 7 c=0.100 3 mol dm =0.100×103 3 mol m ,所以 cRT =0.100×103 3 mol m ×8.314 3 1 1 Pa m mol K ×298K =248kPa 一般植物细胞汁的渗透压约可达 2000kPa,所以水分可以从植物的根部运送 到数十米高的顶端。 等渗溶液 人体血液的渗透压约为 780kPa,病人注射或输液时,使用 0.9%的 NaCl 溶 液(0.16 3 mol dm )或 5%的葡萄糖溶液(0.28 3 mol dm ),这两种溶液与红 细胞和血浆都是等渗溶液(即渗透压相等)。 人体血液平均的渗透压约为 780kPa。由于人体有保持渗透压在正常范围的 要求,因此,对人体注射或静脉输液时,应使用渗透压与人体内的基本相等的溶 液,在生物学和医学上这种溶液称为等渗溶液,例如临床常用的是质量分数 5.0 %(0.28 3 mol dm )葡萄糖溶液,否则由于渗透作用,可产生严重后果①。如 果把血红细胞放入渗透压较大(与正常血液的相比)的溶液中,血红细胞中的水就 会通过细胞膜渗透出来,甚至能引起血红细胞收缩并从悬浮状态中沉降下来;如 果把这种细胞放入渗透压较小的溶液中,血液中的水就会通过血红细胞的膜流入 细胞中,而使细胞膨胀,甚至能使细胞膜破裂。 反渗透 若外加在溶液上的压力大于渗透压,则会使溶液中的溶剂向纯溶剂方向流 动,使纯溶剂体积增加,该过程叫反渗透。广泛用于海水淡化、工业废水的处理 及溶液的浓缩等,关键在于耐高压半透膜的制备。 3.1.2、 电解质溶液的通性 阿仑尼乌斯根据电解质溶液不服从稀溶液定律的现象,提出了电离理论。 1903 年他获得了诺贝尔化学奖。电离理论认为电解质分子在水溶液中解离成离 子,使得溶液中的微粒数增大,故它们的蒸汽压、沸点、熔点的改变和渗透压数 值都比非电解质大。 解离度——溶液中已解离的电解质的分子数与电解质总分子数之比。 100% 电解质的起始浓度 已解离的电解质浓度 解离度 在日常生活中可见到如海水不易结冰,其凝固点低于 273.15K,而沸点则可 高于 373.15K。又如,工业上或实验室中常采用某些易潮解的固态物质,如氯化 钙、五氧化二磷等作为干燥剂,就是因为这些物质能使其表面所形成的溶液的蒸 气压力显著下降,当它低于空气中水蒸气的分压时,空气中水蒸气可不断凝聚而 进入溶液,即这些物质能不断地吸收水蒸气。若在密闭容器内,则可进行到空气 的分压等于这些物质的(饱和)溶液的蒸气压为止。 再如,利用溶液凝固点下降这一性质,盐和冰的混合物可以作为冷冻剂。冰 的表面上有少量水,当盐与冰混合时,盐溶解在这些水里成为溶液。此时,由于 所生成的溶液中水的蒸气压力低于冰的蒸气压力,冰就融化。冰融化时要吸收熔 化热,使周围物质的温度降低。例如,采用氯化钠和冰的混合物,温度可以降低 到 251K;用氯化钙和冰的混合物,可以降低到 218K。在金属表面处理(见 6.3 节)中,利用溶液沸点上升的原理,使工件在高于 373K 的水溶液中进行处理。例

内蒙古科技大学生物身化学工程学院 王霞平普通化学讲义 如,使用含Na0H和NaNO2的水溶液能将工件加热到413K以上。 附例3.1将质量摩尔浓度均为0.10mol.kg的CaCl2,HC1,HAc,蔗 糖水溶液的粒子数、蒸气压、沸点、凝固点和渗透压按从大到小次序排序: 解:按从大到小次序排序如下: 粒子数:CaC2→HCI→HAc→蔗糖 蒸气压:蔗糖→HAc→HCI→CaCl, 沸点:CaCl,一HCI一HAc一蔗糖 凝固点:蔗糖·HAc→HC1→CaCL, 渗透压:CaCl2→HCI→HAc→蔗糖 根据表3.3可以看出,强电解质如HC1、HAc(AB型)的i接近于2,K,SO (A2B型)的i在2~3间:弱电解质如CH,COOH的i略大于1。因此,对同浓 度(mol·kg或mol·dm3)的溶液来说,其沸点高低或渗透压大小的顺序为: 表3.3几种电解质质量摩尔浓度为0.100m0·g时在水溶液中的i值 观察到的 按式3.3)计算的 电解质 △T'K I=△r'/△T △T/K 0.346 0.18c 1.87 0.355 0.186 1.91 K S0 0.458 0.186 2.46 CH.COOH 0.188 0.186 1.01 AB或AB,型强电解质溶液>AB型强电解质溶液 >弱电解质溶液>非电解质溶液,而蒸气压或凝固点的顺序则相反
内蒙古科技大学生物与化学工程学院 王震平 普通化学讲义 8 如,使用含 NaOH 和 NaNO2 的水溶液能将工件加热到 413K 以上。 附例 3.1 将质量摩尔浓度均为 0.10 1 mol kg 的CaCl2 , HCl , HAc , 蔗 糖水溶液的粒子数、蒸气压、沸点、凝固点和渗透压按从大到小次序排序: 解:按从大到小次序排序如下: 粒子数:CaCl2 → HCl → HAc→ 蔗糖 蒸气压:蔗糖 → HAc → HCl →CaCl2 沸点: CaCl2 → HCl → HAc→ 蔗糖 凝固点:蔗糖 → HAc → HCl →CaCl2 渗透压:CaCl2 → HCl → HAc→ 蔗糖 根据表 3.3 可以看出,强电解质如 HCl 、HAc (AB 型)的 i 接近于 2,K2 SO4 (A2B 型)的 i 在 2~3 间;弱电解质如CH3COOH 的 i 略大于 1。因此,对同浓 度( 1 mol kg 或 3 mol dm )的溶液来说,其沸点高低或渗透压大小的顺序为: 表 3.3 几种电解质质量摩尔浓度为 0.100 1 mol kg 时在水溶液中的 i 值 A2B 或 AB2型强电解质溶液>AB 型强电解质溶液 >弱电解质溶液>非电解质溶液,而蒸气压或凝固点的顺序则相反