
内蒙古科技大学生物与化学工程学院 王震平普通T化学讲义 第四章电化学与金属腐蚀 学习要求 (①)了解原电池的组成、半反应式以及电极电势的概念。能用能斯特方程计算电极电势 和原电池电动势 (②)熟悉浓度对电极电势的影响以及电极电势的应用:能比较氧化剂还原剂的相对强 弱,判断氧化还原反应进行的方向和程度 (3)了解电解池中电解产物一般规律,明确电化学腐蚀及其防止的原理。(选修〉 4.1、原电池 将氧化还原反应的化学能转变为电能的装置, 4.1.1、原电池中的化学反应 4111 原电池组成与反应 令原电池结构 2 →Z2++2g Cu+(ap)+2g Cu( 盐桥的作用:盐桥是一倒插的U型管或其它装置,内含KCI或NO,溶液,可用琼脂溶 胶或多孔塞保护,使KC1或KNO,溶液不会自动流出。补充电荷、维持电荷平衡。 女电池反应 C2++Zn→Zn2++Cu 正极后应, C2+2e台Cu 负极反应: Zn-2e台Zn2 电势: Zn一低,Cu一高 电极名: Zn一负,Cu一正 4112、 若干概念 (①)、原电池是由两个半电池组成的:半电池中的反应就是半反应,即电极反应。因此将 半电池又叫电极。 如:电池反应Cu(s)+2Ag*(aq)=Cu(aq)+2Ag(s) 在负极上发生Cu的氧化反应:Cu(s)=C2(aq)+2e 在正极上发生Ag的还原反应:24g*(aq)+2e=2Ag(s) 对于自发进行的电池反应,都可以把它分成两个部分(相应于两个电极的反应),一个表
内蒙古科技大学生物与化学工程学院 王震平 普通化学讲义 1 第四章 电化学与金属腐蚀 学习要求: (1)了解原电池的组成、半反应式以及电极电势的概念。能用能斯特方程计算电极电势 和原电池电动势 (2) 熟悉浓度对电极电势的影响以及电极电势的应用:能比较氧化剂还原剂的相对强 弱,判断氧化还原反应进行的方向和程度 (3)了解电解池中电解产物一般规律,明确电化学腐蚀及其防止的原理。(选修) 4.1、 原电池 将氧化还原反应的化学能转变为电能的装置。 4.1.1、 原电池中的化学反应 4.1.1.1、 原电池组成与反应 原电池结构 盐桥的作用:盐桥是一倒插的 U 型管或其它装置,内含 KCl 或 KNO3溶液,可用琼脂溶 胶或多孔塞保护,使 KCl 或 KNO3溶液不会自动流出。补充电荷、维持电荷平衡。 电池反应: 2 Cu + Zn → 2 Zn +Cu 正极反应: 2 Cu +2 e Cu 负极反应: Zn - 2 e 2 Zn 电势: Zn —低, Cu —高 电极名: Zn —负, Cu —正 4.1.1.2、 若干概念 (1)、原电池是由两个半电池组成的;半电池中的反应就是半反应,即电极反应。因此将 半电池又叫电极。 如:电池反应Cu (s) + 2 Ag (aq) = 2 Cu (aq) + 2 Ag (s) 在负极上发生Cu 的氧化反应: Cu (s)= 2 Cu (aq)+2 e 在正极上发生 Ag 的还原反应:2 Ag (aq)+2 e =2 Ag (s) 对于自发进行的电池反应,都可以把它分成两个部分(相应于两个电极的反应),一个表

内蒙古料技大学生物与化紫工程学院 玉意平普通T化学拼义 示氧化剂的(被)还原,一个表示还原剂的(被)氧化。对于其中的任一部分称为原电池的 半反应式 (2)、半反应电极反应)涉及同一元素的氧化态和还原态 a(氧化态)+ne台b(还原态) 式中是按所写电极反应中电子的化学计量数 从反应式可以看出,每一个电极反应中都有两类物质:一类是可作还原剂的物质,称为 还原态物质,如上面所写的半反应中的Z C、Ag等:另一类是可作氧化剂的物质 称为氧化态物质,如Zn+、C+、Ag+等。 (3)、氧化态和相应的还原态物质能用来组成电对,通常称为氧化还原电对,用符号“氧 化态还原态”表示 ·般只把作为氧化态和还原态的物质用化学式表示出来,通常不表示电极液的组成。如 铜锌原电池中的两个半电池的电对可分别表示为Zn2*/Zn和C2+/Cu。 又如:Fe1Fe2,O,/OH,Hg,CL2/Hg,MmO:1Mm2+等。 (④)、任一自发的氧化还原反应都可以组成一个原电池。 原电池装置可用图式表示。 规定:负极写在左边,正极写在右边,以双虚垂线()表示盐桥,以单垂线()表示两个 相之间的界面。用“,”来分隔两种不同种类或不同价态溶液。 例如:Cu ·Z原电池可表示为 Zn I ZnSo (a)CuSo (e)I Cu(+) 4.1.1.3 电极类型 用来组成半电池电极的氧化还原电对,除金属与其对应的金属盐溶液以外,还有非 金属单质及其对应的非金属离子(如H21H*,O,/OH,C12/CI)、同一种金属不同 价的离子(如Fe1Fe2+,C5,O2/Cr+,MnO/Mm2+)等。对于后两者,在组成电极时 常需外加惰性导电体材料(惰性电极)如P1,以氢电极为例,可表示为 H*(c)|H2(p|P1。 令四类常见电极 电极类型 电对(例) 电极 金属电极 Zn2+/7n Zn (c)Zn 非金属电极 Cr (e)Cl (p)|Pr 氧化还原电极 Fe/Fe Fe (cl).Fe (c2)Pt 难溶盐电极 AgCl/Ag CI-(c)AgCI Ag *难溶盐电极:在金属表面覆盖一薄层该金属难溶盐,然后进入含该难溶盐负离子的溶 液中构成 *难溶盐电极还包含难溶氧化物电极: 如Ag,01Ag OH-(c)Ag,O+Ag:Ag,0+H,0+2e-=2Ag+20H H*(c)Ag,0+Ag g,0+2H+2e=2Ag+H,0 4.1.2、原电池的热力 4.1.2.1、 电池反应的△G.与电动势E的关系 对电动势为E的电池反应:
内蒙古科技大学生物与化学工程学院 王震平 普通化学讲义 2 示氧化剂的(被)还原,一个表示还原剂的(被)氧化。对于其中的任一部分称为原电池的 半反应式。 (2)、半反应(电极反应)涉及同一元素的氧化态和还原态: a(氧化态) + n e b(还原态) 式中 n 是按所写电极反应中电子的化学计量数 从反应式可以看出,每一个电极反应中都有两类物质:一类是可作还原剂的物质,称为 还原态物质,如上面所写的半反应中的 Zn 、Cu 、Ag 等;另一类是可作氧化剂的物质, 称为氧化态物质,如 2 Zn 、 2 Cu 、 Ag 等。 (3)、氧化态和相应的还原态物质能用来组成电对,通常称为氧化还原电对,用符号“氧 化态/还原态”表示。 一般只把作为氧化态和还原态的物质用化学式表示出来,通常不表示电极液的组成。如, 铜锌原电池中的两个半电池的电对可分别表示为 2 Zn / Zn 和 2 Cu /Cu 。 又如: 3 2 Fe / Fe , O2 /OH , Hg2Cl2 / Hg , 2 4 MnO / Mn 等。 (4)、任一自发的氧化还原反应都可以组成一个原电池。 原电池装置可用图式表示。 规定:负极写在左边,正极写在右边,以双虚垂线()表示盐桥,以单垂线(|)表示两个 相之间的界面。用“,”来分隔两种不同种类或不同价态溶液。 例如:Cu - Zn 原电池可表示为 (-) Zn | ZnSO4 (c1) CuSO4 (c2)|Cu (+) 4.1.1.3、 电极类型 用来组成半电池电极的氧化还原电对,除金属与其对应的金属盐溶液以外,还有非 金属单质及其对应的非金属离子(如 H2 / H , O2 /OH , Cl /Cl 2 )、同一种金属不同 价的离子(如 3 2 Fe / Fe , 2 3 2 7 Cr O /Cr , 2 4 MnO / Mn )等。对于后两者,在组成电极时 常需外加惰性导电体材料(惰性电极)如 Pt ,以氢电极为例,可表示为 H (c)| H2 (p)| Pt 。 四类常见电极 电极类型 电对(例) 电极 金属电极 2 Zn / Zn 2 Zn (c)| Zn 非金属电极 Cl /Cl 2 Cl (c)| Cl2 (p)| Pt 氧化还原电极 3 2 Fe / Fe 3 Fe (c1), 2 Fe (c2)| Pt 难溶盐电极 AgCl / Ag Cl (c)| AgCl | Ag *难溶盐电极:在金属表面覆盖一薄层该金属难溶盐,然后进入含该难溶盐负离子的溶 液中构成 *难溶盐电极还包含难溶氧化物电极: 如 Ag2O / Ag OH (c)| Ag2O + Ag : Ag2O + H2O +2 e =2 Ag +2 OH H (c)| Ag2O + Ag : Ag2O +2 H +2 e =2 Ag + H2O 4.1.2、 原电池的热力学 4.1.2.1、 电池反应的Gm与电动势 E 的关系 对电动势为 E 的电池反应:

内蒙古科技大学生物与化学工程学院 王震平普通化学讲义 Cu2+Zn→Zn2++Cu 根据标准摩尔生成焓和标准摩尔生成吉布斯函数,可求得(298.15K时) △,Hm=-217.2kJ·moΓ △,G.=-212.69kJ·mol 由于△,G是系统可用来做非体积功的那部分能量,在原电池中,非体积功w'即为电功 w. △,Gn=wM=-QE=-nFE,1F=96485Cmol:单位物质的量所带电量 △,G.=-nFE or△,G=-nFE9 从热力学的化学反应等温式中,可得到下式: Po/ △G.T)=△,G(T)+RTln E=E°- 公 [c(产物)/c°P [c(反应物)/e] 上式称为电动势的能斯特(黑,Nernst)方程,电动势是强度性质,其值与反应中化学计量 数的选配 在T=398.15K时,将自然对数换成常用对数,有: E=E°-005917严gLc4产物)/c n Ic(反应物)/c°° 4.1.2.2 电池反应的K与标准电动势E的关系 已知K与△,G的关系如下: △,G=-RTInK 而△,G=-nFE,可得:nK°=nFE RT 当1=298.15K时:gK°= 0.05917V 以上讨论可知,电化学方法实际上是热力学方法的具体运用
内蒙古科技大学生物与化学工程学院 王震平 普通化学讲义 3 2 Cu + Zn → 2 Zn +Cu 根据标准摩尔生成焓和标准摩尔生成吉布斯函数,可求得(298.15K 时): r Hm = -217.2 1 kJ mol rGm = -212.69 1 kJ mol 由于rGm是系统可用来做非体积功的那部分能量,在原电池中, 非体积功 w即为电功 we rGm = wMAX = QE = nFE ,1 F =96485 1 C mol :单位物质的量所带电量 rGm = nFE or rGm = nFE 从热力学的化学反应等温式中,可得到下式: b B d D r m r m c c p p G (T ) G (T ) RT ln a b c c c c nF RT E E [ ( / ] [ ( / ] ln 反应物) 产物) 上式称为电动势的能斯特(W.Nernst)方程,电动势是强度性质,其值与反应中化学计量 数的选配无关。 在 T=398.15K 时,将自然对数换成常用对数,有: a b [ c( / c ] [ c( / c ] lg n . V E E 反应物) 0 05917 产物) 4.1.2.2、 电池反应的 K 与标准电动势 E 的关系 已知 K 与 rGm的关系如下: rGm RT ln K 而 rGm = nFE ,可得: RT nFE lnK 当 T=298.15K 时: 0.05917V nE lg K 以上讨论可知,电化学方法实际上是热力学方法的具体运用

内蒙古科技大学生物与化学工程学院 王霞平普通化学讲义 4.2、 电极电势 4.2.1、标准电极电势 原电池能够产生电流,表明原电池两极间存在电势差,即每个电极都有一个电势,称 为电极电势。用符号:0(氧化态/还原态)表示。 如:o(Zn2*/Zn):p(Fe+1Fe2*): (O./OH-):(MnO /Mn): p(Cl2/C1)等。 两电极的p值大小(高低)不同,其差值即为电池的电动势£。 E=(正极)-p(负极) 目前测定电极电势0的绝对值尚有困难。在实际应用中只需知道0的相对值而不必 去追究它们的绝对值。 解决问题的办法 国际上统一(人为)规定:标准氢电极的电极电势°为零 0°(H*/H2=0V 令标准氢电极 标准氢电极:将镀有一层疏松铂黑的铂片 插入H+)1(活都是电解质溶液中离子实际 发挥作用的浓度,显然活都的数值由于离子间 相互作用,故比起对应的浓度数值要小一些。 为简便起见,本书近似用c(H+)=1M代替 aH+)=1)的酸溶液中。在298.15K时不断通 入p(H2)=100kPa的纯氢气流,铂黑很易吸附 →22+纯+2a-2H刻+2→g 氢气达到饱和,同时对电化学反应有催化作用, 使氢气很快与溶液中的H*达成平衡。其可逆程度很高,这样组成的电极称为标准氢电 极。在p右上角加“日”以示“标准”,括号中电对“H+/H2”表示“氢电极”。 未知的测定:标准氢电极与待测电极组成原电池后,测其电池反应的电动势E。 附例4.1:Zn一H,在标准条件下组成电池,Zn为负极,在25℃时测得电池的电 动势E=0.7618V。求p°(Zn2+/Zn)=? 解:根据E=0(正极)-0(负极) 0.7618v=0v-o°(Zn2+/Zn) 可求出待测电极o°(Zn2+/Z)的标准电极电势 得:o°(Zn2+/Zn=-0.7618y KCI 上述讨论的电极电势,是在电对的氧化态物质 与还原态 物质处 于可逆平衡状态, 中无电流通过的条件下测得的。这种电极电势称为 Hg2CI 可逆电势或平衡电势。 ◇参比由帮* 使用标准氢电极不方便,一般常用易于制备、使用
内蒙古科技大学生物与化学工程学院 王震平 普通化学讲义 4 4.2、 电极电势 4.2.1、 标准电极电势 原电池能够产生电流,表明原电池两极间存在电势差,即每个电极都有一个电势,称 为电极电势。用符号: (氧化态/还原态)表示。 如: ( 2 Zn / Zn ); ( 3 2 Fe / Fe ); ( O2 /OH ); ( 2 4 MnO / Mn ); ( Cl /Cl 2 )等。 两电极的 值大小(高低)不同,其差值即为电池的电动势 E 。 E = (正极)- (负极) 目前测定电极电势 的绝对值尚有困难。在实际应用中只需知道 的相对值而不必 去追究它们的绝对值。 解决问题的办法: 国际上统一(人为)规定:标准氢电极的电极电势 为零 H /H2 0V ( ) 标准氢电极 标准氢电极:将镀有一层疏松铂黑的铂片 插入 a H = 1(活都是电解质溶液中离子实际 发挥作用的浓度,显然活都的数值由于离子间 相互作用,故比起对应的浓度数值要小一些。 为简便起见,本书近似用 c( H )=1M 代替 a H = 1)的酸溶液中。在 298.15K 时不断通 入 p H2 =100kPa 的纯氢气流,铂黑很易吸附 氢气达到饱和,同时对电化学反应有催化作用, 使氢气很快与溶液中的 H 达成平衡。其可逆程度很高,这样组成的电极称为标准氢电 极。在 右上角加“ ”以示“标准”,括号中电对“ H2 H / ”表示“氢电极”。 未知 的测定:标准氢电极与待测电极组成原电池后,测其电池反应的电动势 E 。 附例 4.1: Zn H2在标准条件下组成电池, Zn 为负极,在 25℃时测得电池的电 动势 E = 0.7618V。求 ( Zn / Zn ) 2 = ? 解:根据 E = (正极)- (负极) 0.7618V = 0V– ( Zn / Zn ) 2 可求出待测电极 ( Zn / Zn ) 2 的标准电极电势 得: ( Zn / Zn ) 2 =-0.7618V 上述讨论的电极电势,是在电对的氧化态物质 与还原态物质处于可逆平衡状态,且在整个原电池 中无电流通过的条件下测得的。这种电极电势称为 可逆电势或平衡电势。 参比电极* 使用标准氢电极不方便,一般常用易于制备、使用 K C KCl溶液 Hg2Cl H Pt
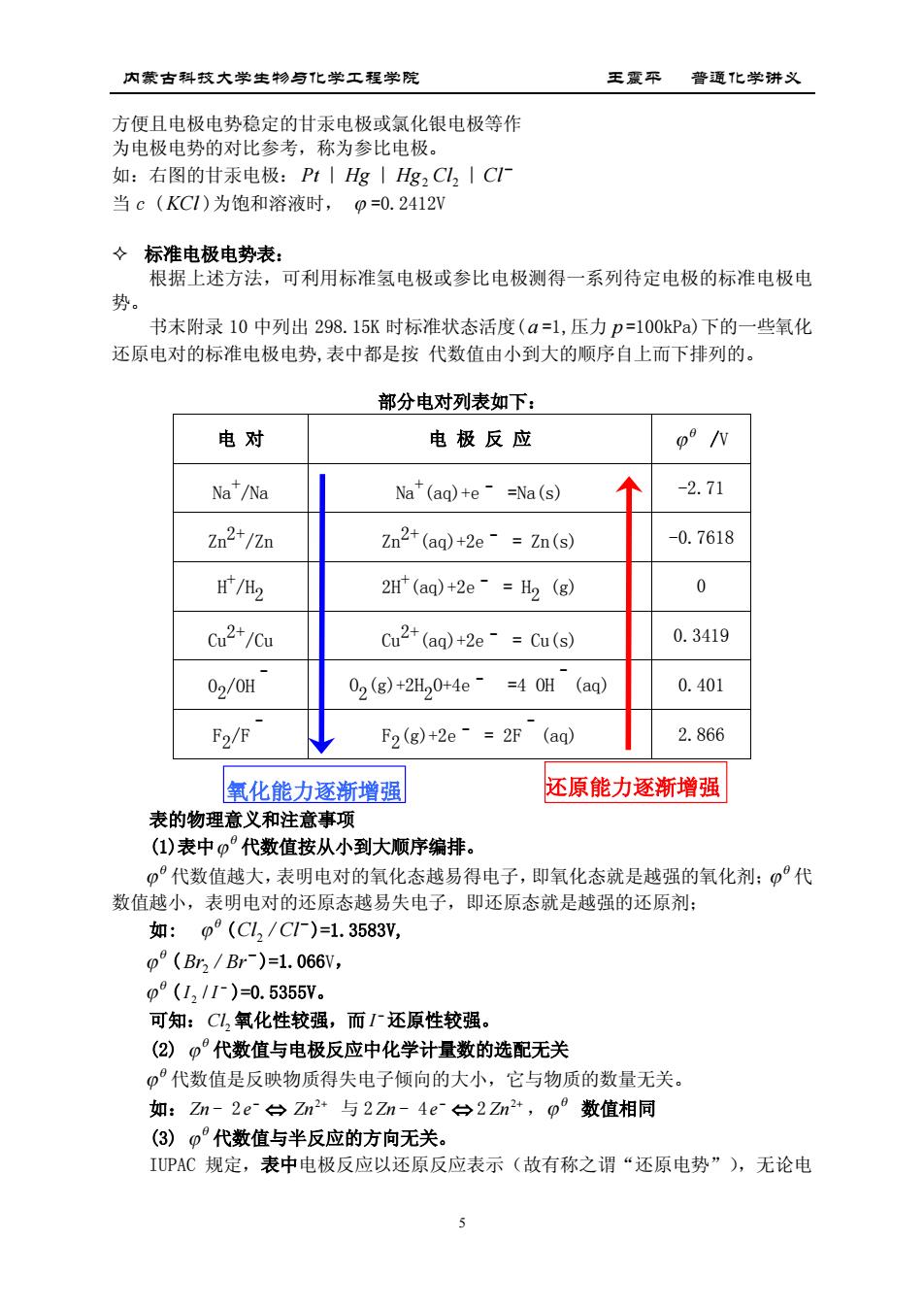
内蒙古科技大学生物与化学工程学院 王震平普通化学讲义 方便且电极电势稳定的甘汞电极或氯化银电极等作 为电极电势的对比参考,称为参比电极。 如:右图的甘汞电极:Pt|g|Hg2Cl,IC1 当c(KC1)为饱和溶液时,p=0.2412V 々标准电极电势表: 根据上述方法,可利用标准氢电极或参比电极测得一系列待定电极的标准电极电 势。 书末附录10中列出298.15K时标准状态活度(a=1,压力p=100kPa)下的一些氧化 还原电对的标准电极电势,表中都是按代数值由小到大的顺序自上而下排列的。 部分电对列表如下: 电对 电极反应 o /v Na/Na Na(aq)+e·=Na(s) -2.71 Zn2+/Zn Zn2+(aq)+2e-=Zn(s) -0.7618 /H2 2H(aq)+2e-=H2 (g) 0 Cu2*/Cu Cu2+(aq)+2e-=Cu(s) 0.3419 02/0H 02(g)+2H0+4e =40H(aq) 0.401 F2/F F2(g)+2e·=2F(aq 2.866 氧化能力逐渐增强 还原能力逐渐增强 表的物理意义和注意事项 (1)表中0°代数值按从小到大顺序编排 0°代数值越大,表明电对的氧化态越易得电子,即氧化态就是越强的氧化剂:0°代 数值越小,表明电对的还原态越易失电子,即还原态就是越强的还原剂: 如:p°(CL2/C1)=1.3583y, p°(Br2/Br)=1.066v, p°(1211)=0.5355V。 可知:C氧化性较强,而厂还原性较强。 (2)0°代数值与电极反应中化学计量数的选配无关 φ°代数值是反映物质得失电子倾向的大小,它与物质的数量无关。 如:Zn-2e白Zn2+与2Zn-4e台2Zn2*,o°数值相同 (3)°代数值与半反应的方向无关。 IUPAC规定,表中电极反应以还原反应表示(故有称之谓“还原电势”),无论电
内蒙古科技大学生物与化学工程学院 王震平 普通化学讲义 5 方便且电极电势稳定的甘汞电极或氯化银电极等作 为电极电势的对比参考,称为参比电极。 如:右图的甘汞电极: Pt ∣ Hg ∣ Hg2 Cl2 ∣ Cl 当 c (KCl )为饱和溶液时, =0.2412V 标准电极电势表: 根据上述方法,可利用标准氢电极或参比电极测得一系列待定电极的标准电极电 势。 书末附录 10 中列出 298.15K 时标准状态活度( a =1,压力 p =100kPa)下的一些氧化 还原电对的标准电极电势,表中都是按 代数值由小到大的顺序自上而下排列的。 部分电对列表如下: 电 对 电 极 反 应 /V Na+ /Na Na+ (aq)+eˉ =Na(s) -2.71 Zn2+/Zn Zn2+(aq)+2eˉ = Zn(s) -0.7618 H + /H2 2H+ (aq)+2eˉ = H2 (g) 0 Cu2+/Cu Cu2+(aq)+2eˉ = Cu(s) 0.3419 O 2 /OHˉ O 2 (g)+2H2 O+4eˉ =4 OHˉ(aq) 0.401 F 2 /Fˉ F 2 (g)+2eˉ = 2Fˉ(aq) 2.866 表的物理意义和注意事项 (1)表中 代数值按从小到大顺序编排。 代数值越大,表明电对的氧化态越易得电子,即氧化态就是越强的氧化剂; 代 数值越小,表明电对的还原态越易失电子,即还原态就是越强的还原剂; 如: ( Cl / Cl 2 )=1.3583V, ( Br / Br 2 )=1.066V, ( I / I 2 )=0.5355V。 可知:Cl2 氧化性较强,而 I 还原性较强。 (2) 代数值与电极反应中化学计量数的选配无关 代数值是反映物质得失电子倾向的大小,它与物质的数量无关。 如: Zn - 2 e 2 Zn 与 2 Zn - 4 e 2 2 Zn , 数值相同 (3) 代数值与半反应的方向无关。 IUPAC 规定,表中电极反应以还原反应表示(故有称之谓“还原电势”),无论电 氧化能力逐渐增强 还原能力逐渐增强