
第六章元素化学与无机材料 6.1、 金属单质的物理性质 在迄今已发现的109种化学元素中,有87种属于金属元素,其余的为非金属元素。金 屈单质一般具有金屈光泽、良好的导电性、导热性和征展性,而非金屈单质则不然,但位 于周期表p区中硼一硅一砷一碲一砹这一对角线附近的一些元素的性质介于金属元素和非 金属元素之间。各种金属单质的性质有所差异,它们无不与各金属元素的原子结构以及晶 体结构有关 若将金属单质的各种性质变化与周期系相联系, 毕竞还是有者某些规律的 6.1. 熔点、沸点和硬度 在图6.1、图6.2和图6.3中分别列出了一些单质的熔点、沸点和硬度的数据。 从图6.1中可以看出,熔点较高的金属单质集中在第VI副族附近:钨的熔点为3410℃ 是熔点最高的金属。第VI副族的两侧向左和向右,单质的熔点趋于降低:汞的熔点为 -38.842℃, 为液态的金属,铯的熔点也仅28.40℃, 低于人体温度 属单质的沸 变化(见图6.2)大致与熔点变化是平行的, 也是沸点最高的金属 金属单质的硬度数据不全,但自图6.3中仍可看出,硬度较大的也位于第Ⅵ副族附近,铬 是硬度最大的金属(莫氏硬度为9.0),而位于第I剧族两侧的单质的硬度趋于威小。 金属单质的密度也存在着较有规律性的变化,一般说来,各周期中开始的元素,其单 质的密度较小,而后面的密度增大。 在工程上,可按金屈的这些物理性质不同来划分金屈。例如 ,一般将密度小于5g·cm 的称为轻金属①,它们包括元素周期表中的s区(镭除外)金属以及钪、钇、钛和铝等。密 度大于5g·c皿的其他金属则称为重金属。按金属的熔点高低来划分,则有高熔点金属和 低熔点金属。低熔点轻金属多集中在s区,低熔点重金属多集中在第Ⅱ副族以及p区,而 高熔点重金属则多集中在区。通常所说的耐高温金属就是指熔点等于或高于铬的熔 A闪 YIA O . 图6单的点()
第六章 元素化学与无机材料 6.1、 金属单质的物理性质 在迄今已发现的 109 种化学元素中,有 87 种属于金属元素,其余的为非金属元素。金 属单质一般具有金属光泽、良好的导电性、导热性和延展性,而非金属单质则不然,但位 于周期表 p 区中硼-硅-砷-碲-砹这一对角线附近的一些元素的性质介于金属元素和非 金属元素之间。各种金属单质的性质有所差异,它们无不与各金属元素的原子结构以及晶 体结构有关;若将金属单质的各种性质变化与周期系相联系,毕竟还是有着某些规律的。 6.1.1、 熔点、沸点和硬度 在图 6.1、图 6.2 和图 6.3 中分别列出了一些单质的熔点、沸点和硬度的数据。 从图 6.1 中可以看出,熔点较高的金属单质集中在第Ⅵ副族附近;钨的熔点为 3410℃, 是熔点最高的金属。第Ⅵ副族的两侧向左和向右,单质的熔点趋于降低;汞的熔点为 -38.842℃,是常温下唯一为液态的金属,铯的熔点也仅 28.40℃,低于人体温度。 金属单质的沸点变化(见图 6.2)大致与熔点变化是平行的,钨也是沸点最高的金属。 金属单质的硬度数据不全,但自图 6.3 中仍可看出,硬度较大的也位于第Ⅵ副族附近,铬 是硬度最大的金属(莫氏硬度为 9.0),而位于第Ⅵ副族两侧的单质的硬度趋于减小。 金属单质的密度也存在着较有规律性的变化,一般说来,各周期中开始的元素,其单 质的密度较小,而后面的密度增大。 在工程上,可按金属的这些物理性质不同来划分金属。例如,一般将密度小于 5g·cm -3 的称为轻金属①,它们包括元素周期表中的 s 区(镭除外)金属以及钪、钇、钛和铝等。密 度大于 5g·cm -3的其他金属则称为重金属。按金属的熔点高低来划分,则有高熔点金属和 低熔点金属。低熔点轻金属多集中在 s 区,低熔点重金属多集中在第Ⅱ副族以及 p 区,而 高熔点重金属则多集中在 d 区。通常所说的耐高温金属就是指熔点等于或高于铬的熔
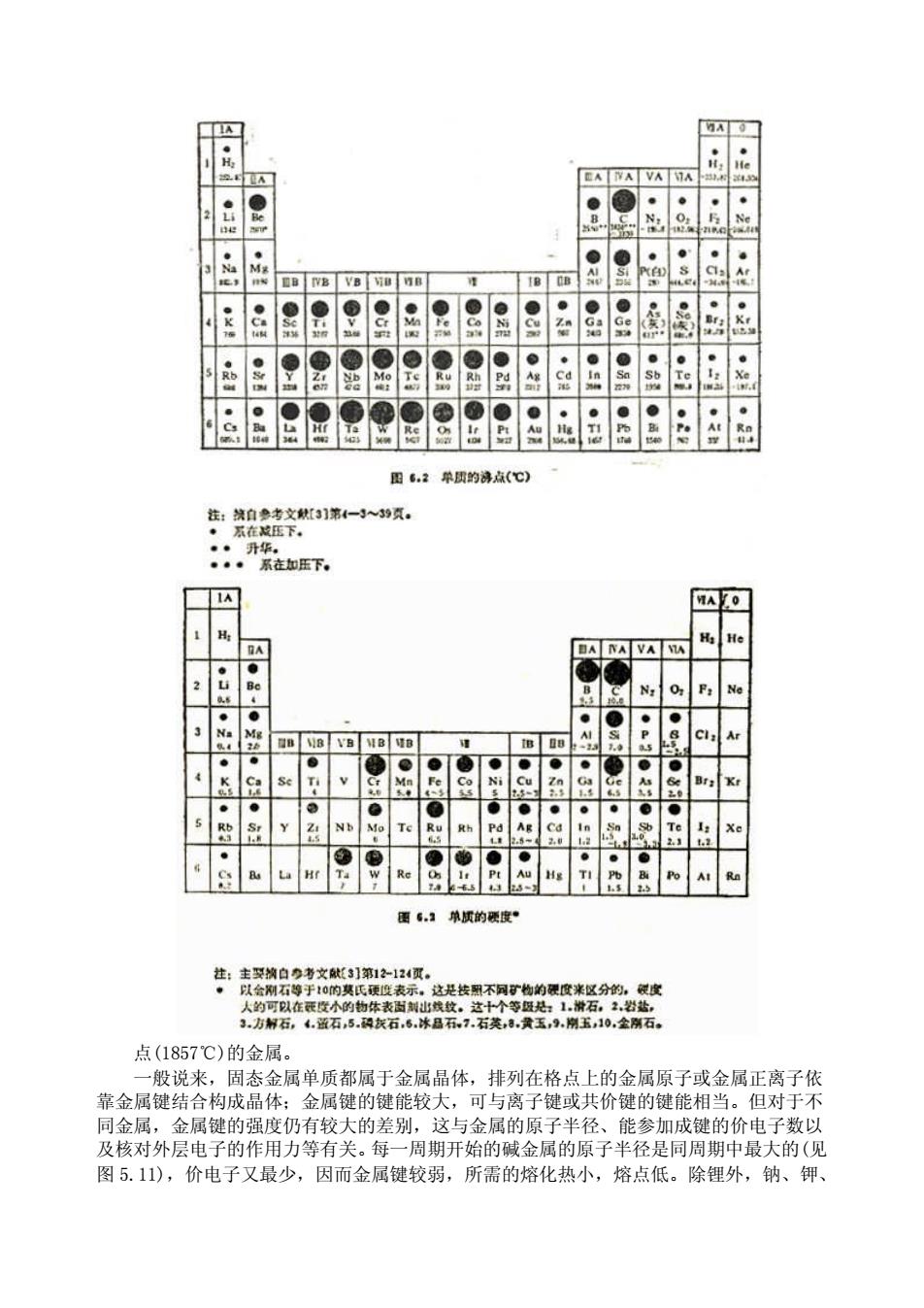
EA NA VA MA BBB@8988888BB88B 图6.2单贯的济点(℃) :.升在下 A0] N, O Pa No EB-99-88883 重6:单质的质度 这是按不同矿物的限度来区分的,限度 方解石,蓝石,5.发石6,冰品石,.石英,.贵玉,.南玉,0金南石 点(1857℃)的金属. 一般说来,固态金属单质都属于金属晶体,排列在格点上的金属原子或金属正离子依 靠金属键结合构成晶体:金属键的键能较大,可与离子键或共价键的键能相当。但对于不 同金属,金属键的强度仍有较大的差别,这与金属的原子半径、能参加成键的价电子数以 及核对外层电子的作用力等有关。每 周期开始的碱金属的原子半径是同周期中最大的(见 图5.11),价电子又最少,因而金属键较弱,所需的熔化热小,熔点低。除锂外,钠、钾
点(1857℃)的金属。 一般说来,固态金属单质都属于金属晶体,排列在格点上的金属原子或金属正离子依 靠金属键结合构成晶体;金属键的键能较大,可与离子键或共价键的键能相当。但对于不 同金属,金属键的强度仍有较大的差别,这与金属的原子半径、能参加成键的价电子数以 及核对外层电子的作用力等有关。每一周期开始的碱金属的原子半径是同周期中最大的(见 图 5.11),价电子又最少,因而金属键较弱,所需的熔化热小,熔点低。除锂外,钠、钾

铷、铯的熔点都在100℃以下。它们的硬度和密度也都较小。从第Ⅱ主族的碱土金属开始 向右进入d区的副族金属,由于原子半径的逐海减小,参与成键的价电子数的逐渐增加( 区元素原子的次外层电子也有可能作为价电子)以及原子核对外层电子作用力的逐渐增 强,金属键的键能将逐渐增大,因而熔点、沸点等也逐渐增高。第Ⅵ副族原子未成对的最 外层s电子和次外层d电子的数目较多,可参与成键,又由于原子半径较小,所以这些元 素单质的熔点、沸点最高。第Ⅶ副族以后,未成对的电子数又逐渐减小,因而金属单质 的熔点、沸点又逐渐降低。部分s区及P区的金属,其晶体类型有从金属晶体向分子晶体 过渡的趋向,这些金属的熔点较低。 6.1.2 导电性 金属都能导电, 是电的良导体,处于区对角线附近的金属,如绪,导电能力介于导 体与绝缘体之间,是半导体(见7.1节)。图6.4中列出了一些单质的电导率数据。 从图6.4中可以看出,银、铜、金、铝是良好的导电材料,而银与金较昂贵、资源稀 少,仅用于某些电子器件连接点等特殊场合:铜和铝则广泛应用于电器工业中。金属铝的 导电率为铜的60%左右,但密度不到铜的一半:再则铝的资源十分丰富,在相同的电流容 量下,使用铝制电线比铜线质量更轻,因此常用铝代 P, 图8.4单质的电导率05◆m-1) 替铜来制造导电材料,特别是高压电缆。 钠的电导率仅为导电率最高的银的1/3,但钠的密度比铝的更小,钠的资源也十分丰 富,目前国外已有试用钠导线的,价格仅为铜的1/7:惟钠十分活泼,用钠作导线时,表 皮采用聚乙烯包裹,并用特殊装置连接 应当指出,金屈的 度以及温度等因素对金属的导电性能影响相当重要。金属中杂质 的存在将使金属的导电率大为降低,所以用作导线的金属往往是相当纯净的。例如按质量 分数计,一般铝线的纯度均在99.5%以上。温度的升高,通常能使金属的导电率下降,对 于不少金属米说,温度每相差1K,导电率将变化约0.4%。金属的这种导电的温度特性也 是有别干半导体的特征之 金屈键理论①可以很好解释金屈的导电性能。金属品体中存在的自由电子是引起金属
铷、铯的熔点都在 100℃以下。它们的硬度和密度也都较小。从第Ⅱ主族的碱土金属开始 向右进入 d 区的副族金属,由于原子半径的逐渐减小,参与成键的价电子数的逐渐增加(d 区元素原子的次外层 d 电子也有可能作为价电子)以及原子核对外层电子作用力的逐渐增 强,金属键的键能将逐渐增大,因而熔点、沸点等也逐渐增高。第Ⅵ副族原子未成对的最 外层 s 电子和次外层 d 电子的数目较多,可参与成键,又由于原子半径较小,所以这些元 素单质的熔点、沸点最高。第Ⅶ副族以后,未成对的 d 电子数又逐渐减小,因而金属单质 的熔点、沸点又逐渐降低。部分 ds 区及 P 区的金属,其晶体类型有从金属晶体向分子晶体 过渡的趋向,这些金属的熔点较低。 6.1.2、 导电性 金属都能导电,是电的良导体,处于 p 区对角线附近的金属,如锗,导电能力介于导 体与绝缘体之间,是半导体(见 7.1 节)。图 6.4 中列出了一些单质的电导率数据。 从图 6.4 中可以看出,银、铜、金、铝是良好的导电材料,而银与金较昂贵、资源稀 少,仅用于某些电子器件连接点等特殊场合;铜和铝则广泛应用于电器工业中。金属铝的 导电率为铜的 60%左右,但密度不到铜的一半;再则铝的资源十分丰富,在相同的电流容 量下,使用铝制电线比铜线质量更轻,因此常用铝代 替铜来制造导电材料,特别是高压电缆。 钠的电导率仅为导电率最高的银的 1/3,但钠的密度比铝的更小,钠的资源也十分丰 富,目前国外已有试用钠导线的,价格仅为铜的 1/7;惟钠十分活泼,用钠作导线时,表 皮采用聚乙烯包裹,并用特殊装置连接。 应当指出,金属的纯度以及温度等因素对金属的导电性能影响相当重要。金属中杂质 的存在将使金属的导电率大为降低,所以用作导线的金属往往是相当纯净的。例如按质量 分数计,一般铝线的纯度均在 99.5%以上。温度的升高,通常能使金属的导电率下降,对 于不少金属来说,温度每相差 1K,导电率将变化约 0.4%。金属的这种导电的温度特性也 是有别于半导体的特征之一。 金属键理论①可以很好解释金属的导电性能。金属晶体中存在的自由电子是引起金属 导电的根本原因,即金属是属于电子导体。对于金属中微粒排列十分规整的理想晶体来说, 在外电场的作用下,晶体内的自由电子几乎可以无阻碍地定向运动。但当金属晶体中存在

其他杂质原子(缺陷)时,对电子的运动有阻碍作用,金属的导电性下降。温度的升高,这 种阻碍作用更为显著,金属的导电性也将会降低。 6.2、 金属单质的化学性质 由于金属元素的电负性较小,在进行化学反应时倾向于失去电子,因而金属单质最突 出的化学性质总是表现出还原性。 6.2.1、 还原性 1.金属单质的活泼性 金属单质的还原性与金属元素的金属性虽然并不完全一致,但总体的变化趋向还是服 从元素周期律的。即在短周期中,从左到右由于一方面核电荷数依次增多,原子半径逐 缩小 另 方 最外月 电子 次增多 ,同一周期从左到 之属单质的还原性逐渐减频 在长周期中总的递变情况和短周期是一致的。但由于副族金属元素的原子半径变化没有主 族的显著,所以同周期单质的还原性变化不甚明显,甚至彼此较为相似。在同一主族中自 上而下,虽然核电荷数增加,但原子半径也增大,金属单质的还原性一般增强:而副族的 情况较为复杂,单质的还原性一般反而减弱。可简单表达如下: IA 工A -VIA 氧化性增强 ITB- -IB 还原性增经不明里 还原性增强 现就金属与氧的作用和金属的溶解分别说明如下: (1)金屁与氧的作用 s区金属十分活泼,具有很强的还原性。它们很容易与氧化合 氧化物(如Na,0、Ba0)。过氧化物中存在着过氧离子02,其中含有过氧键一0一0一。这 些过氧化物都是强氧化剂,遇到棉花、木炭或银粉等还原性物质时,会发生爆炸,所以使 用它们时要特别小心 钾、铷、绝以及钙、锶、钡等金属在过量的氧气中燃烧时还会生成超氧化物(如KO、 Ba0,等)。 过氧化物和超氧化物都是固体储氧物质,它们与水作用会放出氧气,装在面具中,可 供在缺氧环境中工作的人员呼吸用。例如,超氧化钾能与人呼吸时所排出气体中的水蒸气 发生反应: 4K0,(s)+2H0(g) =30(g)+4KOH(s) 呼出气体中的二氧化碳则可被氢氧化钾所吸收: K0H(s)+0(g)= KHCO,(s) p区金属的活泼性一般远比s区金属的要弱。锡、铅、锑、铋等在常温下与空气无显 著作用。铝较活泼,容易与氧化合,但在空气中铝能立即生成一层致密的氧化物保护膜, 阻止氧化反应的进 步i 因而在常温下 ,铝在空气中很稳定 d区(除第副族外)和s区金属的活泼性也较弱。 同周期中各金属单质活泼性的变化 情况与主族的相类似,即从左到右一般有逐渐减弱的趋势,但这种变化远较主族的不明显。 例如,对于第4周期金属单质,在空气中一般能与氧气作用。在常温下钪在空气中迅速氧 化:钛、钒对空气都较稳定:铬、锰能在空气中缓慢被氧化,但铬与氧气作用后,表面形 成的三氧化二铬(Cr03)也具有阻碍进一步氧化的作用;铁、钻、镍在没有潮气的环境中与
其他杂质原子(缺陷)时,对电子的运动有阻碍作用,金属的导电性下降。温度的升高,这 种阻碍作用更为显著,金属的导电性也将会降低。 6.2、 金属单质的化学性质 由于金属元素的电负性较小,在进行化学反应时倾向于失去电子,因而金属单质最突 出的化学性质总是表现出还原性。 6.2.1、 还原性 1.金属单质的活泼性 金属单质的还原性与金属元素的金属性虽然并不完全一致,但总体的变化趋向还是服 从元素周期律的。即在短周期中,从左到右由于一方面核电荷数依次增多,原子半径逐渐 缩小,另一方面最外层电子数依次增多,同一周期从左到右金属单质的还原性逐渐减弱。 在长周期中总的递变情况和短周期是一致的。但由于副族金属元素的原子半径变化没有主 族的显著,所以同周期单质的还原性变化不甚明显,甚至彼此较为相似。在同一主族中自 上而下,虽然核电荷数增加,但原子半径也增大,金属单质的还原性一般增强;而副族的 情况较为复杂,单质的还原性一般反而减弱。可简单表达如下: 现就金属与氧的作用和金属的溶解分别说明如下: (1)金属与氧的作用 s 区金属十分活泼,具有很强的还原性。它们很容易与氧化合, 与氧化合的能力基本上符合周期系中元素金属性的递变规律。 s 区金属在空气中燃烧时除能生成正常的氧化物(如 Li2O、BeO、MgO)外,还能生成过 氧化物(如 Na2O2、BaO2)。过氧化物中存在着过氧离子 O ,其中含有过氧键-O-O-。这 些过氧化物都是强氧化剂,遇到棉花、木炭或银粉等还原性物质时,会发生爆炸,所以使 用它们时要特别小心。 钾、铷、铯以及钙、锶、钡等金属在过量的氧气中燃烧时还会生成超氧化物(如 KO2、 BaO4等)。 过氧化物和超氧化物都是固体储氧物质,它们与水作用会放出氧气,装在面具中,可 供在缺氧环境中工作的人员呼吸用。例如,超氧化钾能与人呼吸时所排出气体中的水蒸气 发生反应: 4KO2(s)+2H2O(g) 3O2(g)+4KOH(s) 呼出气体中的二氧化碳则可被氢氧化钾所吸收: KOH(s)+CO2(g) KHCO3(s) p 区金属的活泼性一般远比 s 区金属的要弱。锡、铅、锑、铋等在常温下与空气无显 著作用。铝较活泼,容易与氧化合,但在空气中铝能立即生成一层致密的氧化物保护膜, 阻止氧化反应的进一步进行,因而在常温下,铝在空气中很稳定。 d 区(除第Ⅲ副族外)和 ds 区金属的活泼性也较弱。同周期中各金属单质活泼性的变化 情况与主族的相类似,即从左到右一般有逐渐减弱的趋势,但这种变化远较主族的不明显。 例如,对于第 4 周期金属单质,在空气中一般能与氧气作用。在常温下钪在空气中迅速氧 化;钛、钒对空气都较稳定;铬、锰能在空气中缓慢被氧化,但铬与氧气作用后,表面形 成的三氧化二铬(Cr2O3)也具有阻碍进一步氧化的作用;铁、钴、镍在没有潮气的环境中与

空气中氧气的作用并不显著,镍也能形成氧化物保护膜:铜的化学性质比较稳定,而锌的 活泼性较强,但锌与氧气作用生成的氧化锌薄膜也具有一定的保护性能。 前面己指出,在金属单质活泼性的递变规律上,副族与主族又有不同之处。在副族金 属中,同周期间的相似性较同族间的相似性更为显著,且第4周期中金属的活泼性较第5 和第6周期金属的为强,或者说副族金属单质的还原性往往有自上而下逐渐减弱的趋势。 例如对于第I副族,铜(第4周期)在常温下不与干燥空气中的氧气化合,加热时则生成黑 色的C0,而银(第5周期)在空气中加执也并不变暗,金(第6周期)在高温下也不与氧气 作用。 (2)金属的溶解 金属的还原性还表现在金属单质的溶解过程中。这类氧化还原反应 可以用电极电势予以说 S区金属的标准电极电势代数值一殿甚小,用H0作氧化剂即能将金属容解(金属被氧 化为金属离子)。皱和镁由于表面形成致密的氧化物保护膜面对水较为稳定。 p区(除锑、铋外)和第4周期区金属(如铁、镍)以及锌的标准电极电势虽为负值, 但其代数值比s区金属的要大 能溶于盐酸或稀硫酸等非氧化性酸中而置换出氢气[显然 酸中(/)代数值比水中的P(任/H)代数值要大,为什么?]。而第5、6周期区和ds 区金属以及铜的标准电极电势则多为正值,这些金属单质不溶于非氧化性酸(如盐酸或稀硫 酸)中,其中 些金属必须用氧化性酸( 1硝酸)予以溶解(此 讨氧化剂已不是 活泼的金属如铂、金需用王水溶解,这是由于 王水中的浓盐酸可提供配合剂C1而与金属离 子形成配离子(见本节金属的配合性能),从而使金属的电极电势代数值大为减小(为什么?) 的缘故。 3Pt+4HN0+18HC1=3HPtC1.1+4N0(g)+3H0 铌、钽、钉、铑、锇、铱等不溶于王水中,但可藉浓硝酸和浓氢氟酸组成的混合酸予 以溶解。 应当指出,p区的铝、镓、锡、铅以及d区的铬,s区的锌等还能与碱溶液作用。例 如: 2A1+2Na0H+2H,0—2NaA10,+3H(g Sn+2Na0H=Na.SnO,+H.(g) 这与这些金属的氧化物或氢氧化物保护膜具有两性有关,或者说由于这些金属的氧化 物或氢氧化物保护膜能与过量Na0H作用生成配离子(例如,A102实质上可认为是配离子 [A1(O)]的简写). 第5和第6周期中,第V副族的锆、铪,第V副族的铌、钽,第I副族的钼、钨以及 第VⅦ副族的锝、铼等金属不与氧、氯、硫化氢等气体反应,也不受一般酸碱的侵蚀,且能 保持原金属或合金的强度和硬度。它们都是耐蚀合金元素,可提高钢在高温时的强度、耐 磨性和耐蚀性。 其中 钽不溶于王水中,细可用手 制造化学工业中的耐酸设备 第Ⅷ族的铂系金属钉、铑、钯、锇、铱、铂以及第I副族的银、金,化学性最为不活 泼(银除外),统称为贵金属。这些金属在常温,甚至在一定的高温下不与氟、氯、氧等非 金属单质作用:其中钉、铑、饿和铱甚至不与王水作用。铂即使在它的熔化温度下也具有 抗氧化的性能,常用于制作化学器皿或仪器零件,例如铂坩埚、铂蒸发器、铂电极等。保 石业标 存在巴黎的国际 是用质量分数为10%Ir和90%Pt的合金制成的。铂系金属在 泛用作催化剂。 顺便指出,副族元素中的第副族,包括铜系元素和钢系元素单质的化学性质是相当 活泼的。常将第副族的钇和15种镧系元素合称为稀土元素
空气中氧气的作用并不显著,镍也能形成氧化物保护膜;铜的化学性质比较稳定,而锌的 活泼性较强,但锌与氧气作用生成的氧化锌薄膜也具有一定的保护性能。 前面已指出,在金属单质活泼性的递变规律上,副族与主族又有不同之处。在副族金 属中,同周期间的相似性较同族间的相似性更为显著,且第 4 周期中金属的活泼性较第 5 和第 6 周期金属的为强,或者说副族金属单质的还原性往往有自上而下逐渐减弱的趋势。 例如对于第Ⅰ副族,铜(第 4 周期)在常温下不与干燥空气中的氧气化合,加热时则生成黑 色的 CuO,而银(第 5 周期)在空气中加热也并不变暗,金(第 6 周期)在高温下也不与氧气 作用。 (2)金属的溶解 金属的还原性还表现在金属单质的溶解过程中。这类氧化还原反应 可以用电极电势予以说明。 s 区金属的标准电极电势代数值一般甚小,用 H2O 作氧化剂即能将金属溶解(金属被氧 化为金属离子)。铍和镁由于表面形成致密的氧化物保护膜面对水较为稳定。 p 区(除锑、铋外)和第 4 周期 d 区金属(如铁、镍)以及锌的标准电极电势虽为负值, 但其代数值比 s 区金属的要大,能溶于盐酸或稀硫酸等非氧化性酸中而置换出氢气[显然, 酸中 (H+ /H2 )代数值比水中的 (H+ /H2)代数值要大,为什么?]。而第 5、6 周期 d 区和 ds 区金属以及铜的标准电极电势则多为正值,这些金属单质不溶于非氧化性酸(如盐酸或稀硫 酸)中,其中一些金属必须用氧化性酸(如硝酸)予以溶解(此时氧化剂已不是 H +了)。一些不 活泼的金属如铂、金需用王水溶解,这是由于王水中的浓盐酸可提供配合剂 Cl-而与金属离 子形成配离子(见本节金属的配合性能),从而使金属的电极电势代数值大为减小(为什么?) 的缘故。 3Pt+4HNO3+18HCl 3H2[PtCl6]+4NO(g)+3H2O Au+HNO3+4HCl H[AuCl4]+NO(g)+2H2O 铌、钽、钌、铑、锇、铱等不溶于王水中,但可藉浓硝酸和浓氢氟酸组成的混合酸予 以溶解。 应当指出,p 区的铝、镓、锡、铅以及 d 区的铬,ds 区的锌等还能与碱溶液作用。例 如: 2Al+2NaOH+2H2O 2NaAlO2+3H2(g) Sn+2NaOH Na2SnO2 +H2(g) 这与这些金属的氧化物或氢氧化物保护膜具有两性有关,或者说由于这些金属的氧化 物或氢氧化物保护膜能与过量 NaOH 作用生成配离子(例如,AlO 实质上可认为是配离子 [Al(OH)4] - 的简写)。 第 5 和第 6 周期中,第Ⅳ副族的锆、铪,第Ⅴ副族的铌、钽,第Ⅵ副族的钼、钨以及 第Ⅶ副族的锝、铼等金属不与氧、氯、硫化氢等气体反应,也不受一般酸碱的侵蚀,且能 保持原金属或合金的强度和硬度。它们都是耐蚀合金元素,可提高钢在高温时的强度、耐 磨性和耐蚀性。其中铌、钽不溶于王水中,钽可用于制造化学工业中的耐酸设备。 第Ⅷ族的铂系金属钌、铑、钯、锇、铱、铂以及第Ⅰ副族的银、金,化学性最为不活 泼(银除外),统称为贵金属。这些金属在常温,甚至在一定的高温下不与氟、氯、氧等非 金属单质作用;其中钌、铑、锇和铱甚至不与王水作用。铂即使在它的熔化温度下也具有 抗氧化的性能,常用于制作化学器皿或仪器零件,例如铂坩埚、铂蒸发器、铂电极等。保 存在巴黎的国际标准米尺也是用质量分数为 10%Ir 和 90%Pt 的合金制成的。铂系金属在 石油化学工业中广泛用作催化剂。 顺便指出,副族元素中的第Ⅲ副族,包括镧系元素和锕系元素单质的化学性质是相当 活泼的。常将第Ⅲ副族的钇和 15 种镧系元素合称为稀土元素