实验十一硫酸亚铁铵的制备 实验目的 ?练永然的过逃雪过滤、蒸发与结品等基本操作 习用 目测比色法检验产品质量。 2. 实验提要 硫酸亚铁铵(NH,)nF(S0)n·6讯0又称摩尔盐,为浅蓝绿色单斜晶体。它在空气中比一般亚铁盐 配:路化:李里不臣系:亚纳格作皮水亮距斋装容裂整饕建黎發是 制造工艺简单,容易得到较纯净的品体 肥料,在定量分析中常用作氧化还原滴定的基准物质。 像所有的复盐一样,疏酸亚铁铵在水中的溶解度比组成它的任何一个组分FeS04或(NH4)2S04的溶 解度都要小,见表5一1。因此从Fe2S04和(N4)2S04溶于水所制得的浓混合溶液中,很容易得到结晶 的摩尔盐。 表5一1 铵盐在水中的溶解度(以100g20)中盐的克数计 温度T/K 273 283 293 303 313 393 333 FeS0a·7Ho0 15.6 20.5 26.5 32.9 40.2 48.6 (NH4)2S04 70.6 73.0 75.4 78.0 81.6 88.0 (NH4)2Fe(S04)26H20125 17.2 33.0 40.0 本实验采用过量铁与稀硫酸作用生成硫酸亚铁: Fe+H2SO=FeS04H2 t 往硫酸亚铁溶液中加人硫酸铵并使其全部溶解,加热浓缩制得的混合溶液,再冷却即可得到溶 解度较小的硫酸亚铁铵晶体: Fes04十(NH4)2S04+620=(NH4)2S04·Fes04·6H20 为防上Fe2+的水解,在制备(0NH4)2S04·FeS04·6H20过程中,溶液应保持足够的酸度。 用日测比色法可估计产品中所含杂质Fe3+的量。由于Fe3+能与SCN一生成红色的物质[Fe SCN)12+ 。3+协丝 只要将所制各的硫酸 铁铵品体与KSC溶 明产品中含Fe3+较少 液在比色管中 溶 所现的红 所以 定P。量所配制成的标准F©(SC)]2*溶液的红色进行比较,根据红色深浅程度相仿的情况,即可知 待测溶液中杂质Fe3+的含量,从而可确定产品的等级。 三.实验仪器和试 仪 锥形瓶(150mlL), 烧杯 量筒(10 50),漏斗,漏斗架,蒸发皿,布氏漏斗,吸 滤瓶 精灯,表面皿, 水浴(可用大烧杯代替),比色管(25mL)。 试剂:HC1(2mol·L-),2S04(3mol·L),0.0100mg·ml-标准Fe3+溶液(称取0.0864g分析纯 硫酸高铁铵Fe(4)(S04)2·12H20溶于3mL2mol·L-HC1并全部转移到1000mL容量瓶中,用去离子水 稀释到刻度,摇匀。),KSCN(1mol·Ll),(NH4)2S04(s),Na2C03,铁屑,乙醇(95%),pH试纸。 四.实验内容 1.铁屑的净化(除去油污 用台秤称取2.0g铁屑 放人小烧杯中,加入10mL质量分数10%Na2C03溶液。缓缓加热约10min后 (不能煮干),倾倒去N2CO3碱性溶液,用自来水冲洗后,再用去离子水把铁屑冲洗洁净(如果用纯净 的铁屑,可省去这一步) 2.硫酸亚铁的制备: 往盛有2.0g洁净铁屑的小烧杯中加入15mL3mol·L-H2S04溶液,盖上表面皿,放在低温电炉加 款装出来部关舞新本品补奇整整期水分使侯精有统酸 趁热用普通漏斗过滤
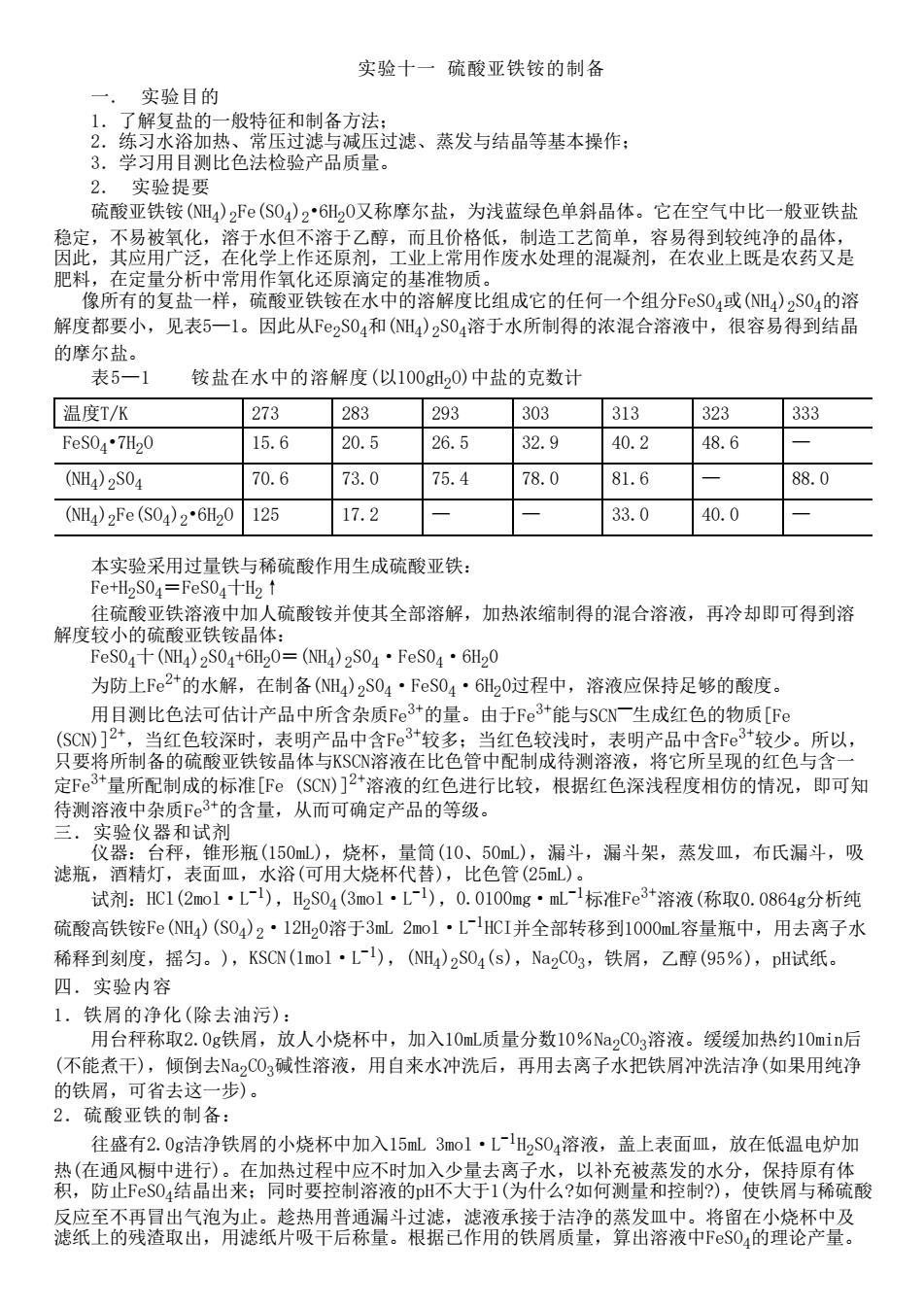
实验十一 硫酸亚铁铵的制备 一. 实验目的 1.了解复盐的一般特征和制备方法; 2.练习水浴加热、常压过滤与减压过滤、蒸发与结晶等基本操作; 3.学习用目测比色法检验产品质量。 2. 实验提要 硫酸亚铁铵(NH4)2Fe(SO4)2•6H2O又称摩尔盐,为浅蓝绿色单斜晶体。它在空气中比一般亚铁盐 稳定,不易被氧化,溶于水但不溶于乙醇,而且价格低,制造工艺简单,容易得到较纯净的晶体, 因此,其应用广泛,在化学上作还原剂,工业上常用作废水处理的混凝剂,在农业上既是农药又是 肥料,在定量分析中常用作氧化还原滴定的基准物质。 像所有的复盐一样,硫酸亚铁铵在水中的溶解度比组成它的任何一个组分FeSO4或(NH4)2S04的溶 解度都要小,见表5—1。因此从Fe2S04和(NH4)2S04溶于水所制得的浓混合溶液中,很容易得到结晶 的摩尔盐。 表5—1 铵盐在水中的溶解度(以100gH2O)中盐的克数计 温度T/K 273 283 293 303 313 323 333 FeSO4•7H2O 15.6 20.5 26.5 32.9 40.2 48.6 — (NH4)2S04 70.6 73.0 75.4 78.0 81.6 — 88.0 (NH4)2Fe(SO4)2•6H2O 125 17.2 — — 33.0 40.0 — 本实验采用过量铁与稀硫酸作用生成硫酸亚铁: Fe+H2S04=FeS04十H2↑ 往硫酸亚铁溶液中加人硫酸铵并使其全部溶解,加热浓缩制得的混合溶液,再冷却即可得到溶 解度较小的硫酸亚铁铵晶体: FeS04十(NH4)2S04+6H2O=(NH4)2S04·FeS04·6H20 为防上Fe2+的水解,在制备(NH4)2S04·FeS04·6H20过程中,溶液应保持足够的酸度。 用目测比色法可估计产品中所含杂质Fe3+的量。由于Fe3+能与SCN—生成红色的物质[Fe (SCN)]2+,当红色较深时,表明产品中含Fe3+较多;当红色较浅时,表明产品中含Fe3+较少。所以, 只要将所制备的硫酸亚铁铵晶体与KSCN溶液在比色管中配制成待测溶液,将它所呈现的红色与含一 定Fe3+量所配制成的标准[Fe (SCN)]2+溶液的红色进行比较,根据红色深浅程度相仿的情况,即可知 待测溶液中杂质Fe3+的含量,从而可确定产品的等级。 三.实验仪器和试剂 仪器:台秤,锥形瓶(150mL),烧杯,量筒(10、50mL),漏斗,漏斗架,蒸发皿,布氏漏斗,吸 滤瓶,酒精灯,表面皿,水浴(可用大烧杯代替),比色管(25mL)。 试剂:HCl(2mol·L-1),H2SO4(3mol·L-1),0.0100mg·mL-1标准Fe3+溶液(称取0.0864g分析纯 硫酸高铁铵Fe(NH4)(SO4)2·12H20溶于3mL 2mol·L-1HCI并全部转移到1000mL容量瓶中,用去离子水 稀释到刻度,摇匀。),KSCN(1mol·L-1),(NH4)2SO4(s),Na2CO3,铁屑,乙醇(95%),pH试纸。 四.实验内容 1.铁屑的净化(除去油污): 用台秤称取2.0g铁屑,放人小烧杯中,加入10mL质量分数10%Na2CO3溶液。缓缓加热约10min后 (不能煮干),倾倒去Na2CO3碱性溶液,用自来水冲洗后,再用去离子水把铁屑冲洗洁净(如果用纯净 的铁屑,可省去这一步)。 2.硫酸亚铁的制备: 往盛有2.0g洁净铁屑的小烧杯中加入15mL 3mol·L-1H2SO4溶液,盖上表面皿,放在低温电炉加 热(在通风橱中进行)。在加热过程中应不时加入少量去离子水,以补充被蒸发的水分,保持原有体 积,防止FeSO4结晶出来;同时要控制溶液的pH不大于1(为什么?如何测量和控制?),使铁屑与稀硫酸 反应至不再冒出气泡为止。趁热用普通漏斗过滤,滤液承接于洁净的蒸发皿中。将留在小烧杯中及 滤纸上的残渣取出,用滤纸片吸干后称量。根据已作用的铁屑质量,算出溶液中FeSO4的理论产量

3.硫酸亚铁铵的制备: 根据FS04的理论产量,计算并称取所需固体(NHy)2S04的用量。在室温下将称出的(NH4)2S04加 入上面所制得的F©S04溶液中在水浴上加热搅拌,使疏酸铵全部溶解,调节pH为1`2,继续蒸发浓缩至 溶液表面刚出现晶膜时为止。自水浴锅上取下蒸发皿,放置,冷却后即有硫酸亚铁铵晶体析出。待 冷至室温后用布氏漏斗减压过滤,用少量乙醇洗去晶体表面所附着的水分。将品体取出,置于两张 洁净的滤纸之间,并轻压以吸干母液,称量。计算理论产量和产率 4.产品检验(选做) ①选用实验方法证明产品中含有NH4、Fe2+和S042。 ②e3+的分析:称取1.0g产品置于25ml比色管中,加入15rmL不含氧的去离子水溶解(怎么处 理?) 加入2L2mo1·1 -lHCI和1mL1mol·L-KSCN2溶液,摇匀后继续加去离子水稀释至刻度,充分 摇匀。将所呈现的红色与下列标准溶液进行目视比色,确定F3+含量及产品标准。 在3只25mL比色管中分别加入2ml2mol·LHC1和1ml1mol·L-KSCN溶液,再用移液管分别加入 5,10,20mL标准Fe3*溶液(0.0100m8 ·ml),加不含氧的去离子水稀释溶液到刻度并摇匀。上述三 只比色管中溶液F3+含量所对应的硫酸亚铁铵试剂规格分别为:含Fe3*0.05g的符合一级品标准:含 Fe+0.10mg的符合二级品标准:含Fe3*0.20mg的符合三级晶标准。 五,实验思考颗 1.为什么制备硫酸亚铁铵时要保持溶液有较强的酸性? 2。减压过滤的操作步骤有哪些? 3.如何计算FeS04理论产量和反应所需NH4)2S04的质量? 4.在检验产品中F3+含量时,为什么要用不含氧的去离子水?如何制备不含氧的去离子水?
3.硫酸亚铁铵的制备: 根据FeSO4的理论产量,计算并称取所需固体(NH4)2SO4的用量。在室温下将称出的(NH4)2SO4加 入上面所制得的FeSO4溶液中在水浴上加热搅拌,使硫酸铵全部溶解,调节pH为1~2,继续蒸发浓缩至 溶液表面刚出现晶膜时为止。自水浴锅上取下蒸发皿,放置,冷却后即有硫酸亚铁铵晶体析出。待 冷至室温后用布氏漏斗减压过滤,用少量乙醇洗去晶体表面所附着的水分。将晶体取出,置于两张 洁净的滤纸之间,并轻压以吸干母液,称量。计算理论产量和产率。 4.产品检验(选做) ①选用实验方法证明产品中含有NH4 +、Fe2+和SO4 2-。 ②Fe3+的分析:称取1.0g产品置于25mL比色管中,加入15rnL不含氧的去离子水溶解(怎么处 理?),加入2mL 2mol·L-1HCl和lmL lmol·L-1KSCN溶液,摇匀后继续加去离子水稀释至刻度,充分 摇匀。将所呈现的红色与下列标准溶液进行目视比色,确定Fe3+含量及产品标准。 在3只25mL比色管中分别加入2mL 2mol·L-1HCl和lmL 1mol·L-1KSCN溶液,再用移液管分别加入 5、10、20mL标准Fe3+溶液(0.0100mg·mL-1),加不含氧的去离子水稀释溶液到刻度并摇匀。上述三 只比色管中溶液Fe3+含量所对应的硫酸亚铁铵试剂规格分别为:含Fe3+0.05mg的符合一级品标准;含 Fe3+0.10mg的符合二级品标准;含Fe3+0.20mg的符合三级晶标准。 五. 实验思考题 1.为什么制备硫酸亚铁铵时要保持溶液有较强的酸性? 2.减压过滤的操作步骤有哪些? 3.如何计算FeSO4理论产量和反应所需(NH4)2SO4的质量? 4.在检验产品中Fe3+含量时,为什么要用不含氧的去离子水?如何制备不含氧的去离子水?