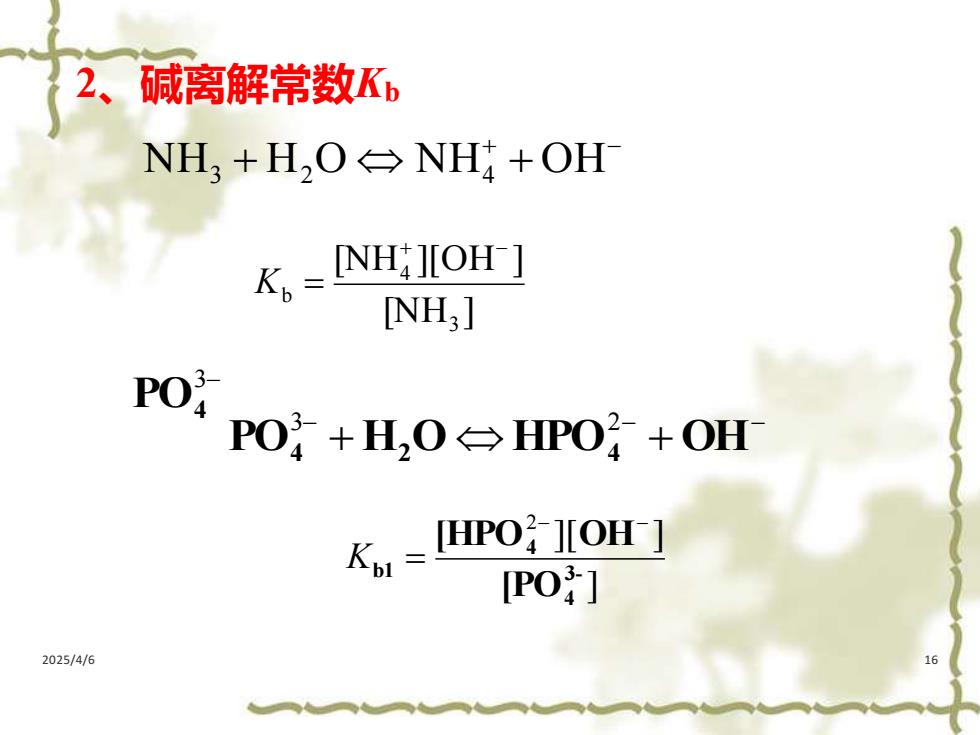
2、碱离解常数Kb NH,+H,O→NH+OH K INH:JOH-] NH;] PO 4PO?+H,0台HPO+OH Ko=HPO IOH [PO] 2025/4/6
2025/4/6 16 2、碱离解常数Kb + − NH3 + H2 O NH4 + OH [NH ] [NH ][OH ] 3 4 b + − K = 3− PO4 ] ][ ] 3- 4 4 b1 [PO [HPO OH − − = 2 K − − − PO4 + H2 O HPO4 + OH 3 2

HPO?+H,O台H,PO4+OH Kn=H,PO;IOu] [HPO] H2PO4+H,0→H3P04+OH [HPO,JOH H,P4] KbI KB2 >Kb3 2025/4/6
2025/4/6 17 − − − HPO4 + H2 O H2 PO4 + OH 2 ] ][ ] 2- 4 2 4 b2 [HPO [H PO OH − − K = − − H2 PO4 + H2 O H3 PO4 + OH ] ][ ] - 2 4 3 b3 [H PO [H PO OH− = 4 K Kb1 Kb2 Kb3

>KK越大,酸碱强度越强; >酸的强度,例如:HAc>NH4>HS: >多元酸HnA,一般Ka1>Ka2>Ka3; > 碱的强度,例如:HS2>NH3>Ac。 NH; Kb=1.8×10- CH NH, K=4.2×104 2025/4/6
2025/4/6 18 ➢ Ka、Kb越大,酸碱强度越强; ➢ 酸的强度,例如:HAc>NH4 + >HS -; ➢ 多元酸HnA,一般Ka1 > Ka2 > Ka3; ➢ 碱的强度,例如:HS2- > NH3 > Ac- 。 4 4 2 10− Kb = . 5 1 8 10− NH3 Kb = . CH3 NH2

3、共轭酸碱对的酸碱强度关系: HAc+H2O台Ac+H,O Ka= [H']Ac] [HAc] Ac+H,O台HAc+OH K,=HAcIIOH [Ac KaK6=[H+]•[OH]=Kw Kw Ko-Ka 2025/4/6
2025/4/6 19 3、共轭酸碱对的酸碱强度关系: − + HAc + H2 O Ac + H3 O [HA ] [H ][A ] C C + − Ka = − − Ac + H2 O HAc +OH [Ac ] [HA ][OH ] C − − Kb = Ka Kb = Kw • = • + − [H ] [OH ] a W b K K K =

或pKa+pKb=14.00 即:一种酸的酸性越强,其共轭碱的碱性越 弱。 示例:HAc~Ac,NH4~NH3 问题:H3P0水溶液中的共轭酸碱对及其酸碱强 度关系如何? Ka1·Kb3=Ka2·Kb2=Ka3·K61=[H][OH]=K 2025/4/6
2025/4/6 20 或 pKa+ pKb=14.00 示例: HAc~ Ac- , NH4 + ~ NH3 问题:H3PO4水溶液中的共轭酸碱对及其酸碱强 度关系如何? 即:一种酸的酸性越强,其共轭碱的碱性越 弱。 Ka Kb Ka Kb Ka Kb = Kw • = • = • = • + − [H ] [OH ] 1 3 2 2 3 1