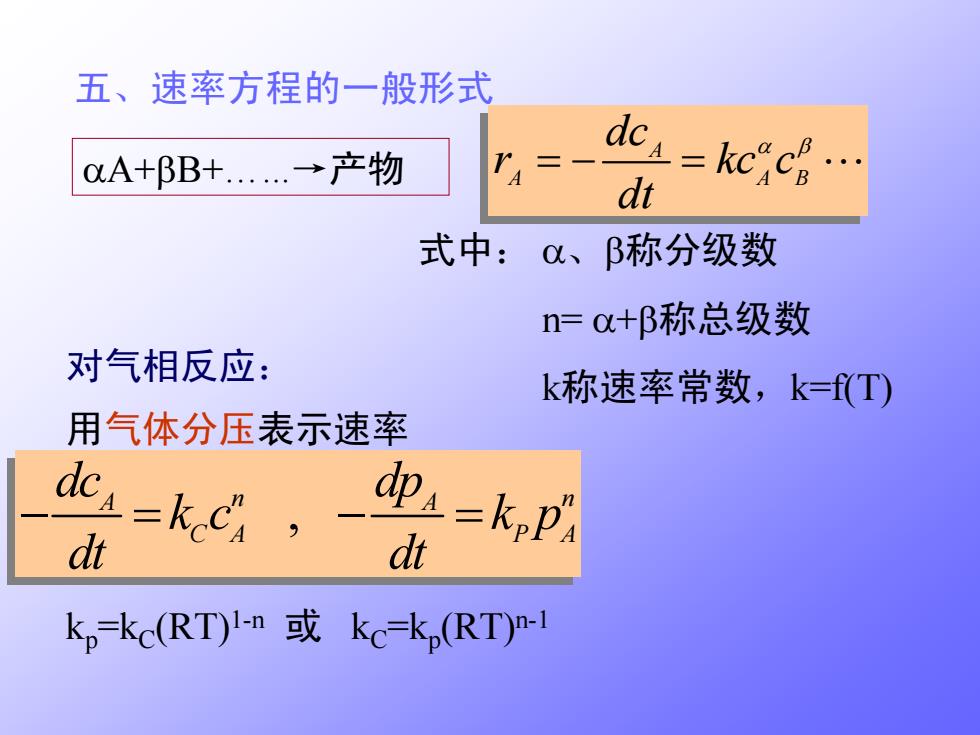
五、速率方程的一般形式 0A+BB+...→产物 dc=kccg… 式中:0、B称分级数 n=+B称总级数 对气相反应: k称速率常数,k=T) 用气体分压表示速率 dcs=kcx 迎a=kp dt kp=kc(RT)1-n kc=kp(RT)n-1
五、速率方程的一般形式 , A A n n C A P A dc dp kc kp dt dt −= −= 用气体分压表示速率 αA+ βB+…...→产物 A A A B dc r kc c dt α β = − = ⋅⋅⋅ 式中: α 、 β称分级数 n= α + β称总级数 k称速率常数,k=f(T) 对气相反应: kp=k C(RT)1-n 或 k C=kp(RT)n-1

§7-3速率方程的积分形式 Integrated rate laws 零级反应 Zero-order reactions A→产物 =1、微分式:-dca/dt=k 2、积分式:ktCA0CA
§7-3 速率方程的积分形式 Integrated rate laws §7-3 速率方程的积分形式 Integrated rate laws 零级反应 Zero-order reactions 零级反应 Zero-order reactions 1、微分式: -dcA/dt=k 2、积分式:kt=cA0-cA A→产物

半衰期定义(Half-lives and time constants): 反应物反应掉初始浓度一半的时间,t2° 3、半衰期:t12=CA0/2K 4、k单位:[浓度][时间]1 5、k的物理意义:单位时间,单位体积内有多少 物质发生反应。 6、线性关系:c与t成直线
6、线性关系: cA与t成直线。 5、k的物理意义:单位时间,单位体积内有多少 物质发生反应。 4、k单位: [浓度]⋅[时间]-1 3、半衰期:t1/2= cA0 /2k 半衰期定义(Half-lives and time constants): 反应物反应掉初始浓度一半的时间,t1/2

一 级反应 First-order reactions A→产物 1、 微分式:-dca/dt=kcA 2、积分式:kt=ln(cAo/cA) 3、半衰期:t2ln2水,与cA0无关 4、k单位:「时间]1(如S1) 5、k的物理意义:单位时间内反应掉的反应物的分数 6、线性关系:IncA~t成直线InCA =IncAo-kt
6、线性关系: lncA ~ t成直线 lnCA =lncA0 - kt 一级反应 First-order reactions 一级反应 First-order reactions 1、微分式:-dcA/dt=kcA 2、积分式:kt=ln(cA0/cA) 3、半衰期: t1/2=ln2/k ,与cA0无关 4、k单位: [时间]-1 ( 如 S-1) 5、k的物理意义:单位时间内反应掉的反应物的分数 A→产物

二级反应 Second-order reactions A→产物 1、 微分式:-dc/dt=-kca2 2、积分式:kt=1/cA-l/CA0 3、半衰期:t12=I/CA0k与cA0成反比 4、k单位:[时间]1[浓度] 5、线性关系:1/cA~t成直线
5、线性关系:1/ cA~ t成直线 二级反应 Second-order reactions 二级反应 Second-order reactions 1、微分式:-dcA/dt=kcA2 2、积分式:kt=1/cA-1/cA0 3、半衰期:t1/2=1/cA0k与cA0成反比 4、k单位: [时间]-1 ⋅[浓度]-1 A→产物