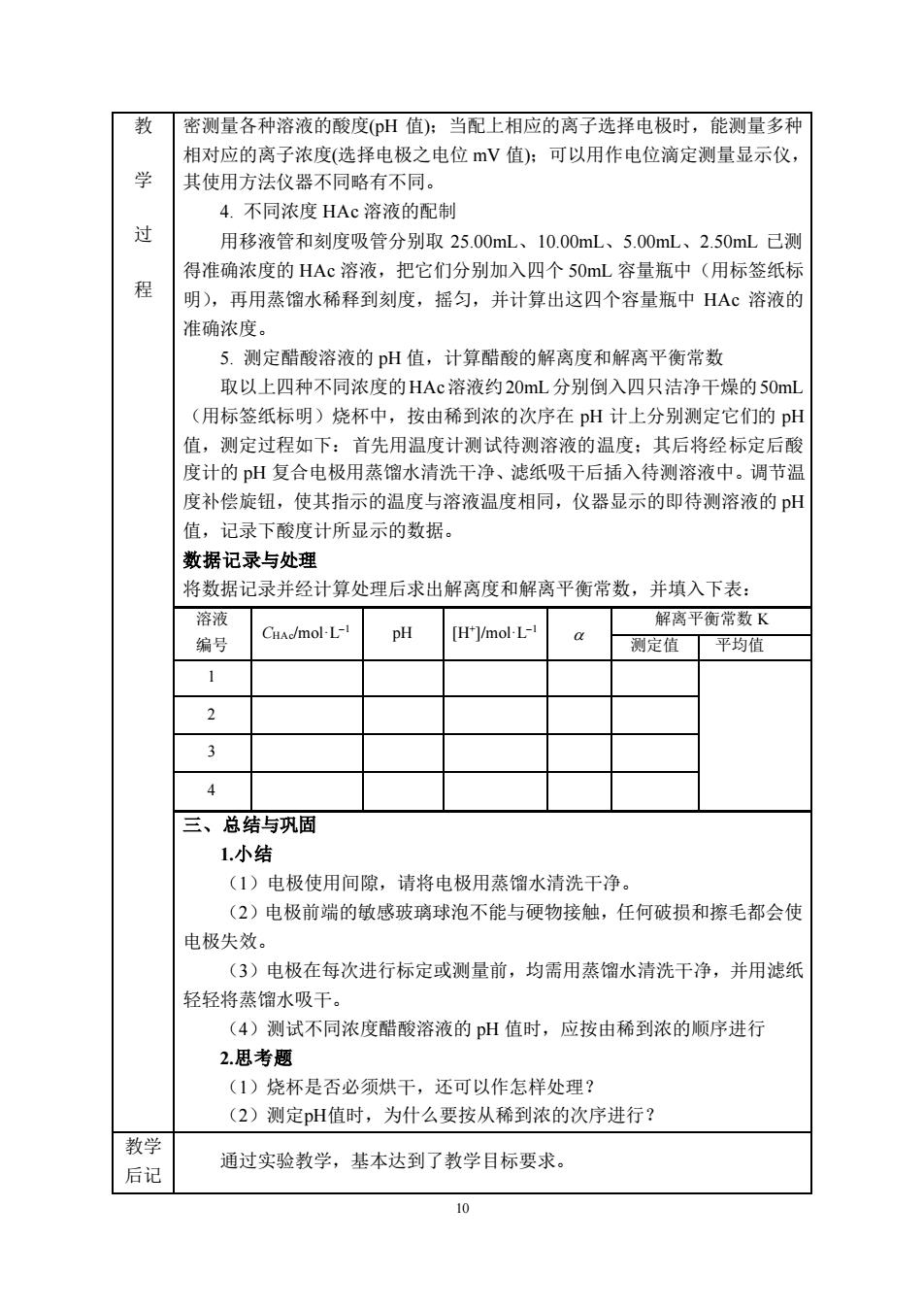
教 密测量各种溶液的酸度(H值):当配上相应的离子选择电极时,能测量多种 相对应的离子浓度(选择电极之电位mV值):可以用作电位滴定测量显示仪, 其使用方法仪器不同略右不同。 4.不同浓度HAC溶液的配制 过 用移液管和刻度吸管分别取25.00mL、10.00mL、5.00mL、2.50mL已测 得准确浓度的HAc溶液,把它们分别加入四个S0mL容量瓶中(用标签纸标 程 明),再用蒸馏水稀释到刻度,摇匀,并计算出这四个容量瓶中HAc溶液的 准确浓度。 5.测定醋酸溶液的pH值,计算醋酸的解离度和解离平衡常数 取以上四种不同浓度的HAc溶液约20mL分别倒入四只洁净干燥的5OmL (用标签纸标明)烧杯中,按由稀到浓的次序在pH计上分别测定它们的pH 值,测定过程如下:首先用温度计测试待测溶液的温度:其后将经标定后酸 度计的pH复合电极用蒸馏水清洗干净、滤纸吸干后插入待测溶液中。调节温 度补偿旋钮,使其指示的温度与溶液温度相同,仪器显示的即待测溶液的pH 值,记录下酸度计所显示的数据。 浙据记录与外避 将数据记录并经计算处理后求出解离度和解离平衡常数,并填入下表: 溶液 CHAd/mol-L-1 pH [H']/mol-L- 解离平衡常数K 编号 测定值平均值 1 3 4 三、总结与巩固 1小结 (1)电极使用间隙,请将电极用蒸馏水清洗干净, (2)电极前端的敏感玻璃球泡不能与硬物接触,任何破损和擦毛都会使 电极失效。 (3)电极在每次进行标定或测量前,均需用蒸馏水清洗干净,并用滤纸 轻轻将蒸馏水吸干。 (4)测试不同浓度醋酸溶液的pH值时,应按由稀到浓的顺序进行 2思考题 (1)烧杯是否必须烘干,还可以作怎样处理? (2)测定pH值时,为什么要按从稀到浓的次序进行? 教学 后记 通过实验教学,基本达到了教学目标要求
10 教 学 过 程 密测量各种溶液的酸度(pH 值);当配上相应的离子选择电极时,能测量多种 相对应的离子浓度(选择电极之电位 mV 值);可以用作电位滴定测量显示仪, 其使用方法仪器不同略有不同。 4. 不同浓度 HAc 溶液的配制 用移液管和刻度吸管分别取 25.00mL、10.00mL、5.00mL、2.50mL 已测 得准确浓度的 HAc 溶液,把它们分别加入四个 50mL 容量瓶中(用标签纸标 明),再用蒸馏水稀释到刻度,摇匀,并计算出这四个容量瓶中 HAc 溶液的 准确浓度。 5. 测定醋酸溶液的 pH 值,计算醋酸的解离度和解离平衡常数 取以上四种不同浓度的HAc溶液约20mL分别倒入四只洁净干燥的50mL (用标签纸标明)烧杯中,按由稀到浓的次序在 pH 计上分别测定它们的 pH 值,测定过程如下:首先用温度计测试待测溶液的温度;其后将经标定后酸 度计的 pH 复合电极用蒸馏水清洗干净、滤纸吸干后插入待测溶液中。调节温 度补偿旋钮,使其指示的温度与溶液温度相同,仪器显示的即待测溶液的 pH 值,记录下酸度计所显示的数据。 数据记录与处理 将数据记录并经计算处理后求出解离度和解离平衡常数,并填入下表: 溶液 编号 CHAc/mol·L–1 pH [H+ ]/mol·L–1 解离平衡常数 K 测定值 平均值 1 2 3 4 三、总结与巩固 1.小结 (1)电极使用间隙,请将电极用蒸馏水清洗干净。 (2)电极前端的敏感玻璃球泡不能与硬物接触,任何破损和擦毛都会使 电极失效。 (3)电极在每次进行标定或测量前,均需用蒸馏水清洗干净,并用滤纸 轻轻将蒸馏水吸干。 (4)测试不同浓度醋酸溶液的 pH 值时,应按由稀到浓的顺序进行 2.思考题 (1)烧杯是否必须烘干,还可以作怎样处理? (2)测定pH值时,为什么要按从稀到浓的次序进行? 教学 后记 通过实验教学,基本达到了教学目标要求

章 实验六碘酸铜的溶度积测定 课时 4 教学 1.了解测定溶度积常数的原理和方法。 目 2.学习分光光度计的使用方法 3测定碘酸铜溶度积常数。 教学 1.溶度积常数的测定原理和方法。 重点 2.分光光度计的使用。 教学 如何利用分光光度法测定溶度积常数。 难点 相关素材(参考资料、指导学生阅读材料等): 1.《无机化学实验》,冯建成、尹学琼、朱莉主编,化学工业出版社 2.《无机化学实验》,大连理工大学无机化学教研室编,高等教育出版社 3.《无机化学》,大连理工大学无机化学教研室编,高等教育出版社 教师授课思路、设问及讲解要点 一、引言 学会利用分光光度法测定溶度积常数。 二、教学内容正文(含讲课内容、提问设计、课堂练习等) 实验原理 碘酸铜是难溶性强电解质,在一定温度下,饱和溶液中的Cu2*和1O,与 固体CuIO32之间存在下列平衡: C10,)2fC2*+210, 平衡时离子相对浓度乘积为一个常数: K”=[Cw2][lO,了 式中Cu2+和1O,为平衡浓度(更确切地说应该是活度,但由于难溶性 强电解质的溶解度很小,离子强度也很小,可以用浓度代替活度)。温度恒 定时,K为常数,它不随Cu+或O,的变化而改变。在一定的温度下,新 制得的碘酸铜固体溶于水后,只要形成饱和溶液,1O,就是Cú2+的2倍,代 过 入上式则K=4C2月 程 碘酸铜饱和溶液中的Cu2+与过量的NH·H0作用生成深蓝色的 配离子CNH,P.C2+4NHf[C(NH)4P 在实验条件下,氨水无色,C浓度很小,也几乎不吸收可见光。因此 测定溶液的吸光度
11 章 实验六 碘酸铜的溶度积测定 课时 4 节 教学 目的 1. 了解测定溶度积常数的原理和方法。 2. 学习分光光度计的使用方法。 3. 测定碘酸铜溶度积常数。 教学 重点 1. 溶度积常数的测定原理和方法。 2. 分光光度计的使用。 教学 难点 如何利用分光光度法测定溶度积常数。 相关素材(参考资料、指导学生阅读材料等): 1. 《无机化学实验》,冯建成、尹学琼、朱莉主编,化学工业出版社 2. 《无机化学实验》,大连理工大学无机化学教研室编,高等教育出版社 3. 《无机化学》,大连理工大学无机化学教研室编,高等教育出版社 教 学 过 程 教师授课思路、设问及讲解要点 一、引言 学会利用分光光度法测定溶度积常数。 二、教学内容正文(含讲课内容、提问设计、课堂练习等) 实验原理 碘酸铜是难溶性强电解质,在一定温度下,饱和溶液中的 Cu2+和 − 3 IO 与 固体 Cu(IO3)2 之间存在下列平衡: 3 2 Cu(IO ) ƒ 2+ Cu +2 − 3 IO 平衡时离子相对浓度乘积为一个常数: 2 3 2 [ ][ ] + − Ksp = Cu IO 式中 Cu2+和 − 3 IO 为平衡浓度(更确切地说应该是活度,但由于难溶性 强电解质的溶解度很小,离子强度也很小,可以用浓度代替活度)。温度恒 定时, Ksp 为常数,它不随 Cu2+或 − 3 IO 的变化而改变。在一定的温度下,新 制得的碘酸铜固体溶于水后,只要形成饱和溶液, − 3 IO 就是 Cu2+的 2 倍,代 入上式则 2 3 4[ ] + Ksp = Cu 。 碘酸铜饱和溶液中的 Cu2+与过量的 NH3·H2O 作用生成深蓝色的 配离子 2+ 3 4 [Cu(NH ) ] : 2 2 3 3 4 Cu NH Cu NH 4 [ ( ) ] + + + ƒ 在实验条件下,氨水无色,Cu2+浓度很小,也几乎不吸收可见光。因此, 测定溶液的吸光度