
第一章 气体的pVT性质 1.1 物质的体膨胀系数,与等温压缩率r的定义如下 1av 留。 试推出理想气体的,,xr与压力、温度的关系。 解:根据理想气体方程P广=RT 1.20℃,101.325kPa的条件常称为气体的标准状况,试求甲烷在标准状况下的密度。 解:将甲烷0M=16.042g/mol)看成理想气体:PV=RT,PV=mRT/M 甲烷在标准状况下的密度为=m/N=PM/RT =101.32516.042/8.3145273.15(kg/m) =0.716kg/m3 1.3一抽成真空的球形容器,质量为25.0000g充以4℃水之后,总质量为125.0000g。若改充以25℃, 13.33kPa的某碳氢化合物气体,则总质量为25.0163g。试估算该气体的摩尔质量。水的密度1g·cm 计算。 解:球形容器的体积为V=(125-25)g/1g.cm=100cm3 将某碳氢化合物看成理想气体:PV=nRT,PV=mRT/M, L=mRT/PV=(25.0163-25.0000)×8.314×298.15/(13330×100×10) Mw =30.31(g/mol) 1.4两个容积均为V的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。若将其中的一个球 加热到100℃,另一个球则维持0℃,忽略连接细管中气体体积,试求该容器内空气的压力。 解:由题给条件知,(1)系统物质总量恒定:(2)两球中压力维持相同。 标准状态:p=101.325kPa,T=273.15K P101325kPa T273.15乐 15R 7315R
第一章 气体的 pVT 性质 1.1 物质的体膨胀系数 与等温压缩率 的定义如下 试推出理想气体的 , 与压力、温度的关系。 解:根据理想气体方程 1.2 0℃,101.325kPa 的条件常称为气体的标准状况,试求甲烷在标准状况下的密度。 解:将甲烷(Mw=16.042g/mol)看成理想气体: PV=nRT , PV =mRT/ Mw 甲烷在标准状况下的密度为=m/V= PMw/RT =101 16.042/8.3145 15(kg/m3 ) =0.716 kg/m3 1.3 一抽成真空的球形容器,质量为 25.0000g 充以 4℃水之后,总质量为 125.0000g。若改充以 25℃, 13.33 kPa 的某碳氢化合物气体,则总质量为 25.0163g。试估算该气体的摩尔质量。水的密度 1g·cm 3 计算。 解:球形容器的体积为 V=(125-25)g/1 g.cm -3 =100 cm3 将某碳氢化合物看成理想气体:PV=nRT , PV =mRT/ Mw Mw= mRT/ PV=(25.0163-25.0000)×8.314×298.15/(13330×100×10 -6 ) Mw =30.31(g/mol) 1.4 两个容积均为 V 的玻璃球泡之间用细管连结,泡内密封着标准状态下的空气。若将其中的一个球 加热到 100℃,另一个球则维持 0℃,忽略连接细管中气体体积,试求该容器内空气的压力。 解:由题给条件知,(1)系统物质总量恒定;(2)两球中压力维持相同。 标准状态:

因此, "=2 RT 所%器 RT,RT =2+2×1012+7}7007 373.15 L.50℃时氯甲烷(CH,C)气体的密度p随压力的变化如下。试作P-p图,用外推法求氯甲烷的相 对分子质量。 p/kPa 101.32567.55050.66333.775 25.331 p/八gdm3) 2.30741.52631.14010.757130.56660 解:对于理想气体 p=mRT/(IM)=RT/M,所以RTp/p=M 对于真实气体,在一定温度下,压力愈低其行为愈接近理想气体,只有当压 力趋近于零时上述关系才成立,可表示为: lim(RTp/p)=RT lim(p/p)=M 0℃时不同压力下的p/p列表如下: p/kPa 101.32567.55550.66333.77525.331 p1《103gd3kPa)2.7222.5952.5042.4172.368 以pl/(10-3gdm3.kPa1)对pkPa作图,可得一直线,如下图
因此, 1.5 0℃时氯甲烷(CH3Cl)气体的密度ρ随压力的变化如下。试作 p p 图,用外推法求氯甲烷的相 对分子质量
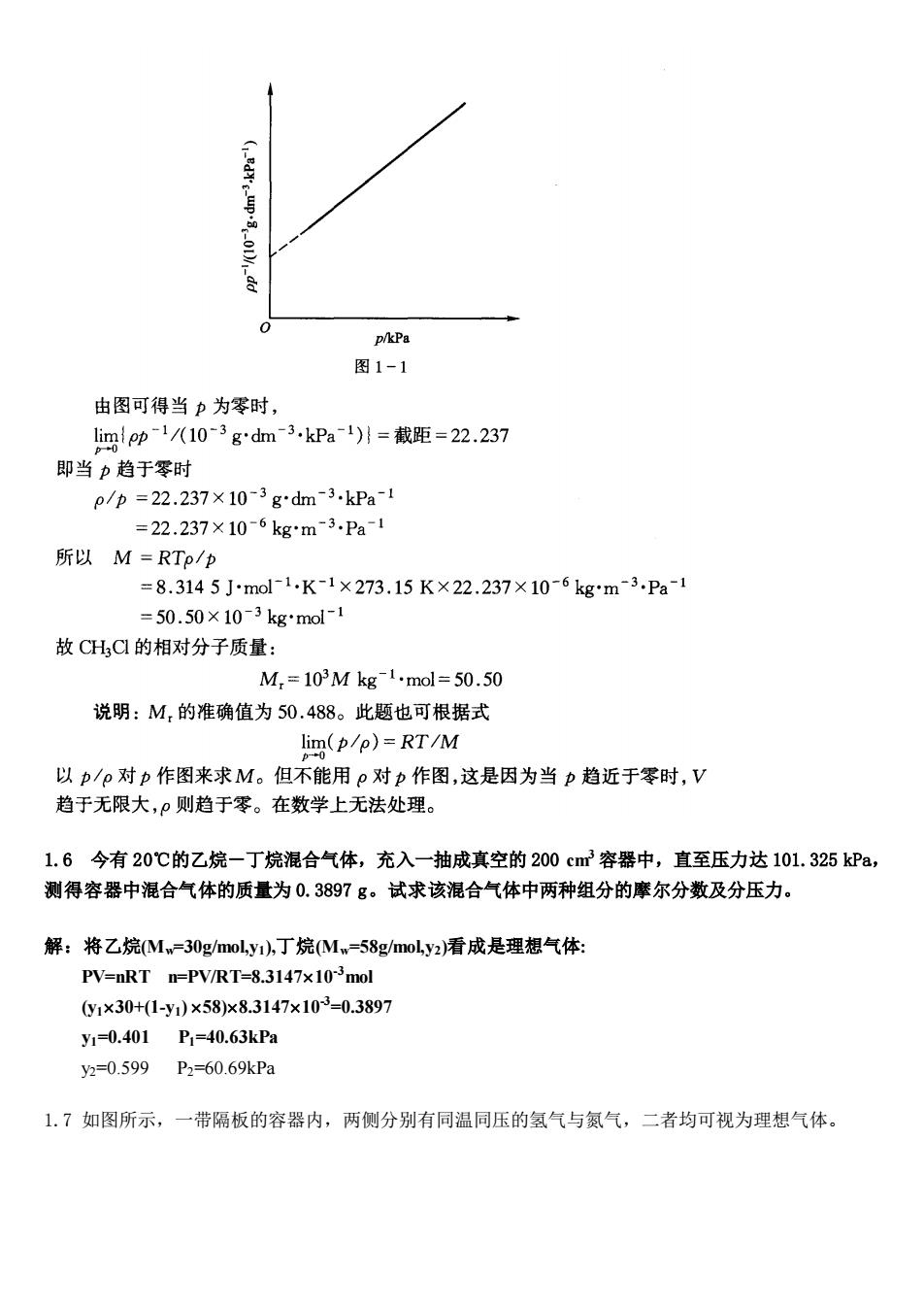
p/kPa 图1-1 由图可得当力为零时, limip-1/10-3gdm3.kPal)1=截距=22.237 即当力趋于零时 p/p=22.237×10-3gdm3.kPa-l =22.237×106kg*m3.Pa1 所以M=RTp/p =8.3145J小mol1.K-1×273.15K×22.237×10-6kgm3.Pa-1 =50.50×10-3 kg'mol-11 故CHC的相对分子质量: M,=103Mkg1mol=50.50 说明:M,的准确值为50.488。此题也可根据式 lim(p/p)=RT/M 以p/P对p作图来求M。但不能用p对p作图,这是因为当p趋近于零时,V 趋于无限大,则趋于零。在数学上无法处理。 1.6今有20℃的乙烷-丁烷混合气体,充入一抽成真空的200cm容器中,直至压力达101.325kPa, 测得容器中混合气体的质量为0.3897g。试求该混合气体中两种组分的摩尔分数及分压力。 解:将乙烷Mw=30 g/moL.y1).丁烷(Mw=58 z/moL.y2)看成是理想气体: PV=nRT n=PV/RT=8.3147x103mol y1×30+1-y1)×58)x8.3147×103=0.3897 y1=0.401 P1=40.63kPa y2=0.599P2=60.69kPa 1.7如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体
1.6 今有 20℃的乙烷-丁烷混合气体,充入一抽成真空的 200 cm3 容器中,直至压力达 101.325 kPa, 测得容器中混合气体的质量为 0.3897 g。试求该混合气体中两种组分的摩尔分数及分压力。 解:将乙烷(Mw=30g/mol,y1),丁烷(Mw=58g/mol,y2)看成是理想气体: PV=nRT n=PV/RT=8.314710 -3mol (y130+(1-y1) 58)8.314710 -3 =0.3897 y1=0.401 P1=40.63kPa y2=0.599 P2=60.69kPa 1.7 如图所示,一带隔板的容器内,两侧分别有同温同压的氢气与氮气,二者均可视为理想气体

3 dm 1 dm (1) 保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试 求两种气体混合后的压力。 (2) 隔板抽取前后,H及N的摩尔体积是否相同? (3) 隔板抽取后,混合气体中H及的分压立之比以及它们的分体积各为若干? 解:(1)等温混合后 之g+TP+D】R2 a,+丁 +)P 即在上述条件下混合,系统的压力认为P。 (2)混合气体中某组分的摩尔体积怎样定义? (3)根据分体积的定义 r但2)=3dm3,r0N2)=1dm3 对于分压 名月 p但2pN2)=3:1 1.8 氯乙烯、氯化氢及乙烯构成的混合气体,各组分的摩尔分数分别为 0.89,0.09及0.02。在恒定压力101.325kPa下,用水吸收掉其中的氯化氢气
(1) 保持容器内温度恒定时抽去隔板,且隔板本身的体积可忽略不计,试 求两种气体混合后的压力。 (2) 隔板抽取前后,H2及 N2的摩尔体积是否相同? (3) 隔板抽取后,混合气体中 H2及 N2的分压立之比以及它们的分体积各为若干? 解:(1)等温混合后 即在上述条件下混合,系统的压力认为 。 (2)混合气体中某组分的摩尔体积怎样定义? (3)根据分体积的定义 对于分压 1.8

体,所得的混合气体中增加了压力为2.670kPa的水蒸气。试求洗涤后混合气 体中氯乙烯和乙烯的分压力。 解:以A,B和D分别代表氯乙烯、乙烯和水蒸气。洗涤后总压力p= 101.325kPa,水蒸气的分压pD=2.670kPa。 nA/nB=0.89/0.02 na/八nA+nB)=0.89/(0.89+0.02)=0.890.91 pA+pB=p-pD=(101.325-2.670)kPa=98.655kPa 对于混合气体压力之比等于物质的量之比,故 pA=(p-D)nA/八nA+nB) =98.655kPa×0.89/0.91 =96.487kPa PB=p-(PA+PD) =101.325kPa-(96.487+2.670)kPa =2.168kPa 1.9室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如 下:向釜内通氮气直到4倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。重复三次。求釜内 最后排气至恢复常压时其中气体含氧的摩尔分数。 解:分析:每次通氮气后至排气恢复至常压,混合气体的摩尔分数不变。 设第一次充氮气前,系统中氧的摩尔分数为0,),充氨气后,系统中氧的摩尔分数为4O,), 则,片(O,)x4p=0)×p→h(O,)=O,4。重复上面的过程,第n次充氮气后,系统的摩尔分数 为 y(O2)=y1O2)/4=02)/4 因此 3(02)=y02)/43=0.313% 1.1025℃时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压) 总压力为138.7kP,于恒定总压下冷却到10℃,使部分水蒸气凝结为水。试求每摩尔干乙炔气在该冷 却过程中凝结出水的物质的量。已知25℃及10℃时水的饱和蒸气压分别为3.17kPa及1.23kPa。 解:该过程图示如下
1.9 室温下一高压釜内有常压的空气,为进行实验时确保安全,采用同样温度的纯氮进行置换,步骤如 下:向釜内通氮气直到 4 倍于空气的压力,尔后将釜内混合气体排出直至恢复常压。重复三次。求釜内 最后排气至恢复常压时其中气体含氧的摩尔分数。 解:分析:每次通氮气后至排气恢复至常压 p,混合气体的摩尔分数不变。 设第一次充氮气前,系统中氧的摩尔分数为 ,充氮气后,系统中氧的摩尔分数为 , 则, 。重复上面的过程,第 n 次充氮气后,系统的摩尔分数 为 , 因此 。 1.10 25℃时饱和了水蒸气的湿乙炔气体(即该混合气体中水蒸气分压力为同温度下水的饱和蒸气压) 总压力为 138.7 kPa,于恒定总压下冷却到 10℃,使部分水蒸气凝结为水。试求每摩尔干乙炔气在该冷 却过程中凝结出水的物质的量。已知 25℃及 10℃时水的饱和蒸气压分别为 3.17 kPa 及 1.23 kPa。 解:该过程图示如下