
离子性盐类溶解性的热力学讨论 1溶解过程的标准自由焓变化 离子性化合物在水中溶解的难易程度,可以根据溶解过程 的标准自由焓变化来加以讨论: △G=△H-T△S 当△G<0,溶解自发进行,即易溶解; △G>0,溶解不能自发进行,即难溶解: △G=0,溶解已处于平衡。 从上式可见,溶解过程的焓变和熵变都对自由焓变化作出 贡献,特别是溶解过程中,焓变通常很小,熵变的重要性有时 十分突出,所以在讨论溶解过程的自由焓变化时,应从△S和 △H两方面进行整体讨论。不过,一般说来,焓变的影响通常很 明显,下面着重说明熵变对自由焓变化的影响
离子性盐类溶解性的热力学讨论 1 溶解过程的标准自由焓变化 离子性化合物在水中溶解的难易程度,可以根据溶解过程 的标准自由焓变化来加以讨论: △G=△H-T△S 当△G < 0,溶解自发进行,即易溶解; △G > 0,溶解不能自发进行,即难溶解; △G=0,溶解已处于平衡。 从上式可见,溶解过程的焓变和熵变都对自由焓变化作出 贡献,特别是溶解过程中,焓变通常很小,熵变的重要性有时 十分突出,所以在讨论溶解过程的自由焓变化时,应从△S和 △H两方面进行整体讨论。不过,一般说来,焓变的影响通常很 明显,下面着重说明熵变对自由焓变化的影响

溶解过程中的熵变包括两个方面: (1)在离子化合物溶解生成水合离子的过程中,由于离子的 电荷强电场的作用,使得在离子周围形成了一个水化层。显然, 水化过程使系统的混乱度减小。 (2)离子的水化破坏了水的簇团结构,使水分子变得自由, 结果是体系混乱度增加,水合熵增加。 因此,溶解过程的熵是增加还是减小决定于这两个方面哪 一个占优势。 显然,当离子的电荷很高和离子半径较小时,离子的电荷 密度较大,第一种效应显然占优势,此时熵值减小,不利于溶 解过程的发生;相反,当离子电荷低、半径大、离子电荷密度 小,此时,第一种效应较弱,此时熵值增加,有利于溶解过程 的进行。 总的说来,当△S<0,熵变项对自由焙变化的贡献是正值, 即△S<0,使盐的溶解性减小。当△S>0,熵变顶对自由焓变化 的贡献是负值,即△S>O,使盐的溶解性增加
溶解过程中的熵变包括两个方面: (1) 在离子化合物溶解生成水合离子的过程中,由于离子的 电荷强电场的作用,使得在离子周围形成了一个水化层。显然, 水化过程使系统的混乱度减小。 (2) 离子的水化破坏了水的簇团结构,使水分子变得自由, 结果是体系混乱度增加,水合熵增加。 因此,溶解过程的熵是增加还是减小决定于这两个方面哪 一个占优势。 显然,当离子的电荷很高和离子半径较小时,离子的电荷 密度较大,第一种效应显然占优势,此时熵值减小,不利于溶 解过程的发生;相反,当离子电荷低、半径大、离子电荷密度 小,此时,第一种效应较弱,此时熵值增加,有利于溶解过程 的进行。 总的说来,当△S<0,熵变项对自由焓变化的贡献是正值, 即△S<0,使盐的溶解性减小。当△S>0,熵变项对自由焓变化 的贡献是负值,即△S>0,使盐的溶解性增加
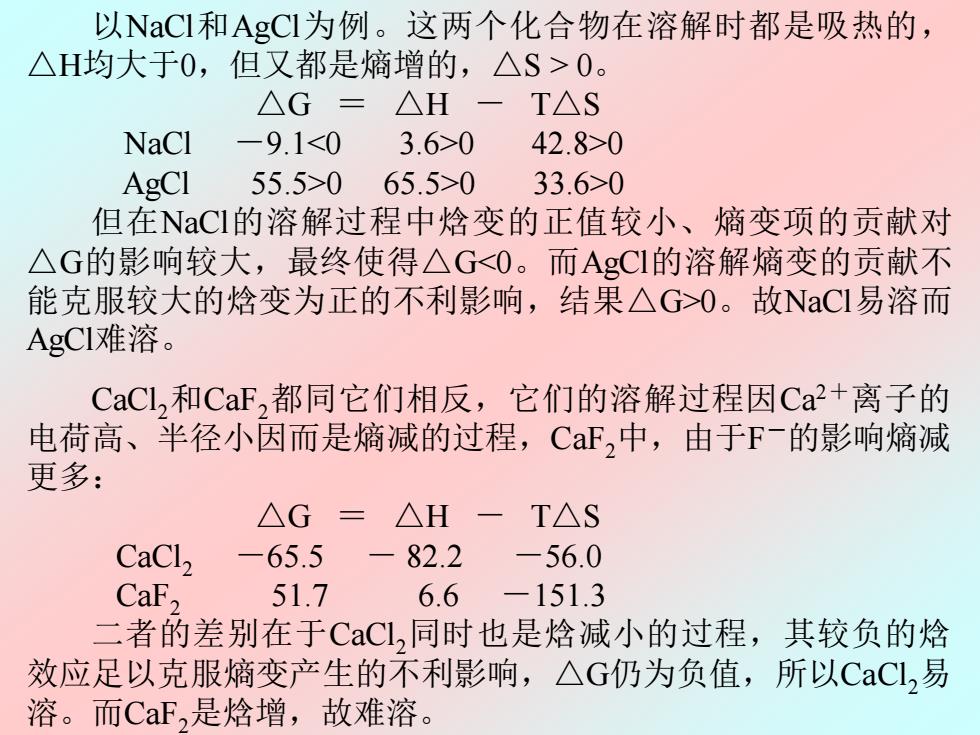
以NaCI和AgCI为例。这两个化合物在溶解时都是吸热的, △H均大于0,但又都是熵增的,△S>0。 △G=△H-T△S NaCl-9.1<03.6>0 42.8>0 AgCl 55.5>065.5>0 33.6>0 但在NaCI的溶解过程中焓变的正值较小、熵变项的贡献对 △G的影响较大,最终使得△G<0。而AgCI的溶解熵变的贡献不 能克服较大的焓变为正的不利影响,结果△G>0。故NaCI易溶而 AgCI难溶。 CaCl,和CaF,都同它们相反,它们的溶解过程因Ca+离子的 电荷高、半径小因而是熵减的过程,CF,中,由于F-的影响熵减 更多: △G=△H -T△S CaCl, -65.5 一 82.2 -56.0 CaF, 51.7 6.6 -151.3 二者的差别在于CaCl,同时也是焓减小的过程,其较负的焓 效应足以克服熵变产生的不利影响,△G仍为负值,所以CaCL,易 溶。而CaF,是焓增,故难溶
以NaCl和AgCl为例。这两个化合物在溶解时都是吸热的, △H均大于0,但又都是熵增的,△S > 0。 △G = △H - T△S NaCl -9.1<0 3.6>0 42.8>0 AgCl 55.5>0 65.5>0 33.6>0 但在NaCl的溶解过程中焓变的正值较小、熵变项的贡献对 △G的影响较大,最终使得△G<0。而AgCl的溶解熵变的贡献不 能克服较大的焓变为正的不利影响,结果△G>0。故NaCl易溶而 AgCl难溶。 CaCl2和CaF2都同它们相反,它们的溶解过程因Ca2+离子的 电荷高、半径小因而是熵减的过程,CaF2中,由于F-的影响熵减 更多: △G = △H - T△S CaCl2 -65.5 - 82.2 -56.0 CaF2 51.7 6.6 -151.3 二者的差别在于CaCl2同时也是焓减小的过程,其较负的焓 效应足以克服熵变产生的不利影响,△G仍为负值,所以CaCl2易 溶。而CaF2是焓增,故难溶

2溶解过程的热力学分析 为了探讨离子性盐溶解自由焓变化的某些规律,先建立一个热力学 循环: M.X,(s) △GCM+(aq) +ax(aq) △atmGm99 IⅡ△Gm9 →cMa+(g) 十 ax(g) △sGm9=△latGmo+△hGm9 也就是说,溶解过程的自由焓变化,包括破坏晶体晶格和离 子水合两个过程的自由焓变化。对于破坏晶体晶格过程: M.X (s)-cMa(aq)+axc-(aq) △aGno=△atHm-T△SiatSm9 L(McXa)-T△1atSm9 1079×105(a+c22-T△amS. r++r_ △arSm9=112.6(a十cJ-k-lmol-1 △atGm 1079×10(ac2r2-31.1a+c)kJmol-
2 溶解过程的热力学分析 为了探讨离子性盐溶解自由焓变化的某些规律,先建立一个热力学 循环: McXa (s) cMa+(aq) + aXc-(aq) I Ⅱ cMa+(g) + aXc-(g) △SGm θ =△latGm θ +△hGm θ 也就是说,溶解过程的自由焓变化,包括破坏晶体晶格和离 子水合两个过程的自由焓变化。对于破坏晶体晶格过程: McXa (s) cMa+(aq)+aXc-(aq) △latGm θ=△latHm θ-T△latSm θ ≈L(McXa )-T△latSm θ = -T△latSm θ △latSm θ=112.6(a+c)J·k-1·mol-1 △latGm θ= -31.1(a+c) kJ·mol-1 △SGm θ △latmGm θ △hGm θ 1.079×105 (a+c)Z+Z- r++r- 1.079×105 (a+c)Z+Z- r++r-

由此式可见: ①破坏晶体,即使之成为无限远离的气态离子,其熵变大 于0,即破坏晶体晶格的熵效应对溶解有利。 ②△latHm~L>0,破坏晶体需耗能,此项对溶解是不利的。 对于水合过程:cMa+(g)十aXc-(g)→cMa+(aq)+aXc-(aq) △hGnf=△hHm9-T△hSm9 ①离子水合是一个放热过程,△Hm<0,即负的水合焓有 利于溶解过程进行; ②水合熵△Sm9=Sm(aq)-Sm(g)<0,即熵效应不利于溶解。 综合以上两个过程: △sGm9=△latGm+△hGne =(△latHm9+△Hn)-T(△latSm+△hSm) =△,Hmf-T△Sm9 可见,溶解自由焓变取决于溶解焙效应和溶解熵效应两顶
由此式可见: ① 破坏晶体,即使之成为无限远离的气态离子,其熵变大 于0,即破坏晶体晶格的熵效应对溶解有利。 ② △latHm≈L>>0,破坏晶体需耗能,此项对溶解是不利的。 综合以上两个过程: △sGm θ=△latGm θ+△hGm θ =(△latHm θ+△hHm θ )-T(△latSm θ+△h Sm θ ) =△sHm θ-T△s Sm θ 对于水合过程:cMa+(g)+aXc-(g) cMa+(aq)+aXc-(aq) △hGm θ=△hHm θ-T△h Sm θ ① 离子水合是一个放热过程,△hHm θ<0,即负的水合焓有 利于溶解过程进行; ② 水合熵△h Sm θ=Sm θ (aq)-Sm θ (g)<0,即熵效应不利于溶解。 可见,溶解自由焓变取决于溶解焓效应和溶解熵效应两项