
五、热和功 体系与环境之间因温度不同而交换或 传递的能量称为热;表示为Q。 规定:体系从环境吸热时,Q为正值; 体系向环境放热时,Q为负值。 功 除了热之外,其它被传递的能量叫做 功;表示为W。 规定:环境对体系做功时,】 W为正值; 体系对环境做功时,W为负值。 ??
五、热和功 1. 热: 体系与环境之间因温度不同而交换或 传递的能量称为热; 表示为Q。 规定:体系从环境吸热时, Q为正值; 体系向环境放热时,Q为负值。 2. 功: 除了热之外,其它被传递的能量叫做 功;表示为W。 规定:环境对体系做功时,W为正值; 体系对环境做功时,W为 负值。 ??

六、状态及状态函数: 1.状态: 表征体系性质的物理量所确定的体系存在形式。 由p、V、T、n等物理量所确定下来的体系 存在的形式称为体系的状态 2.状态函数:确定体系状态的物理量称为状态 函数 3.状态函数的特点:状态函数只与体系的始态 和终态有关,而与变化的过程无关心工
1.状态: 表征体系性质的物理量所确定的体系存在形式。 由 p、V、T、n 等物理量所确定下来的体系 存在的形式称为体系的状态 2. 状态函数: 确定体系状态的物理量称为状态 函数 3. 状态函数的特点:状态函数只与体系的始态 和终态有关,而与变化的过程无关 p、V、T、 n 六、 状态及状态函数:
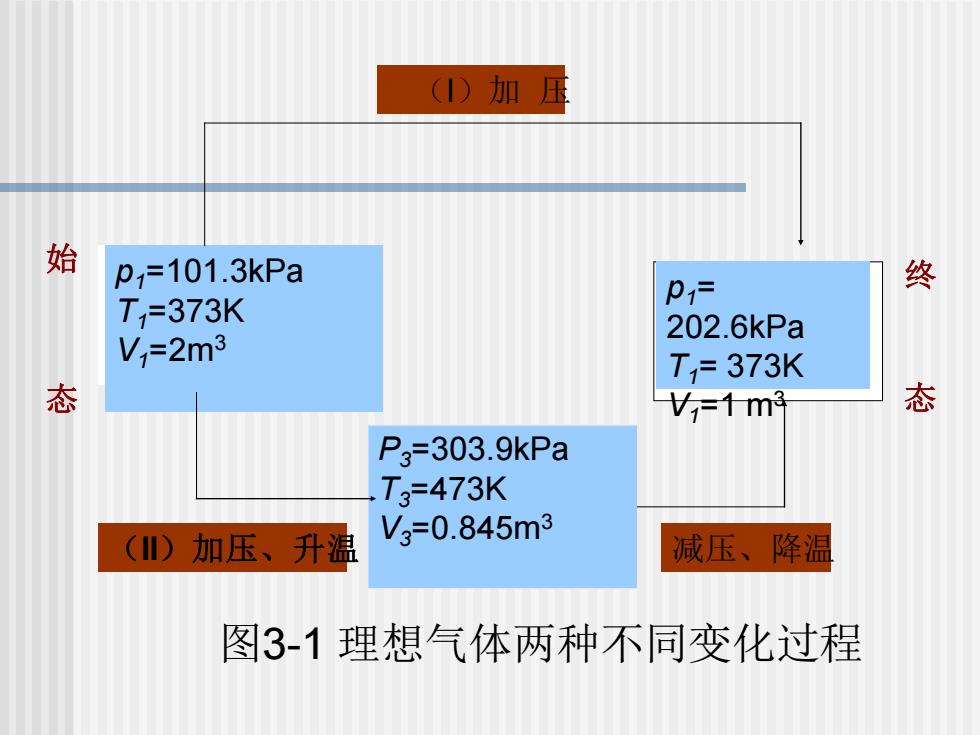
(1)加 始 p=101.3kPa P1= 终 T=373K 202.6kPa V=2m3 T=373K 态 V=13 态 P3=303.9kPa T3=473K () 加压、升温 V3=0.845m3 减压、降温 图3-1理想气体两种不同变化过程
P3=303.9kPa T3=473K V3=0.845m3 p1=101.3kPa T1=373K V1=2m3 p1= 202.6kPa T1= 373K V1=1 m3 (I)加 压 (II)加压、升温 减压、降温 始 态 终 态 图3-1 理想气体两种不同变化过程

七、热力学标准态 ■反应物与生成物都是气体时,各物质的分 压为1.013×105Pa ■反应物与生成物都是液体时,各物质的浓 度为1.0mokg1 ■固体和液体纯物质的标准态指在标准压 力下的纯物质 标准态对温度没有规定,不同温度下有 不同标准态
◼ 反应物与生成物都是气体时,各物质的分 压为1.013 105 Pa ◼ 反应物与生成物都是液体时,各物质的浓 度为1.0 mol• kg-1 ◼ 固体和液体纯物质的标准态指在标准压 力下 的纯物质 ◼ 标准态对温度没有规定,不同温度下有 不同标准态 七、 热力学标准态

5-3化学热力学的四个重要 状态函数 热力学能(内能 学能:体系内部一切能量的总和 称为体系的热力学能(U)。 包括分子运动的动能,分子间的位能以及 分子、原子内部所蕴藏的能量。 问题:U是否为状态函数?U呢?
5-3 化学热力学的四个重要 状态函数 一 、 热力学能(内能) 1.热力学能:体系内部一切能量的总和 称为体系的热力学能(U)。 包括分子运动的动能,分子间的位能以及 分子、原子内部所蕴藏的能量。 问题:U 是否为状态函数?ΔU呢?