
第十六章氮族元素 >本章要求 1.掌握氮和氨的氢化物、氧化物、含氧酸及其盐 的结构和性质 2.掌握磷及其重要化合物的结构和性质 3.掌握砷、锑、铋单质及其化合物的性质 4.掌握氮(磷)化合物的水解反应
第十六章 氮族元素 ➢本章要求 1.掌握氮和氨的氢化物、氧化物、含氧酸及其盐 的结构和性质 2.掌握磷及其重要化合物的结构和性质 3.掌握砷、锑、铋单质及其化合物的性质 4.掌握氮(磷)化合物的水解反应
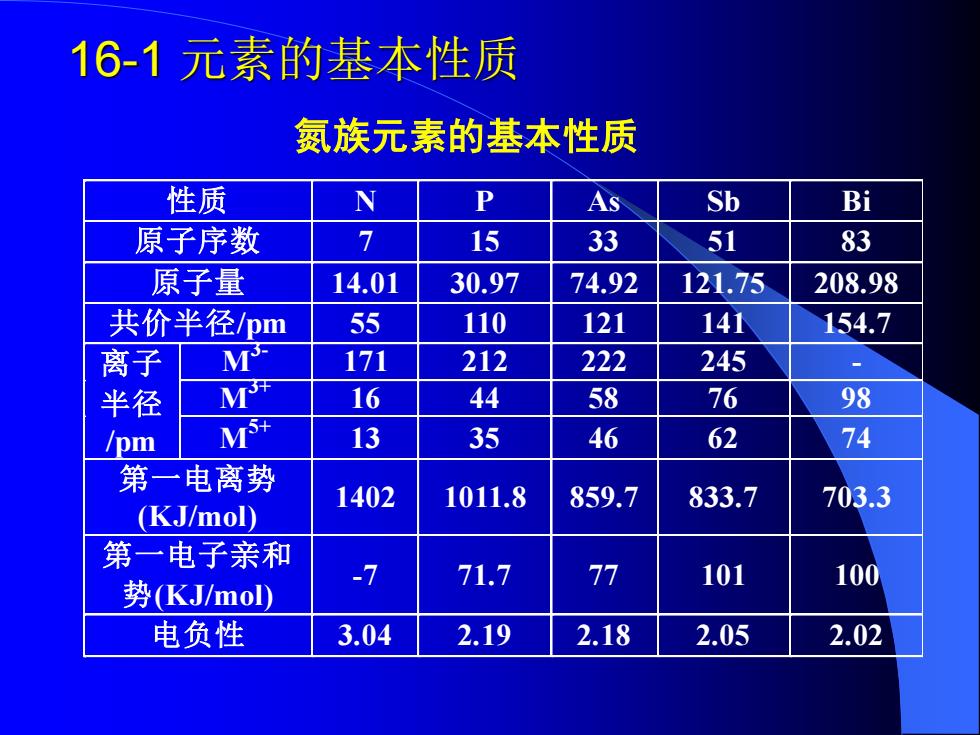
16-1元素的基本性质 氮族元素的基本性质 性质 As Sb Bi 原子序数 7 15 33 51 83 原子量 14.01 30.97 74.92 121.75 208.98 共价半径pm 55 110 121 141 154.7 离子 T 17列 212 222 245 半径 M 16 44 58 76 98 /pm M 13 35 46 62 74 第一电离势 (KJ/mol) 1402 1011.8 859.7 833.7 703.3 第一电子亲和 -7 71.7 77 101 100 势(KJ/mol) 电负性 3.04 2.19 2.18 2.05 2.02
16-1 元素的基本性质 氮族元素的基本性质 性 质 N P As Sb B i 原子序数 7 15 33 51 83 原子量 14.01 30.97 74.92 121.75 208.98 共价半径/pm 55 110 121 141 154.7 M 3- 171 212 222 245 - M 3+ 16 44 58 76 98 离 子 半 径 /pm M 5+ 13 35 46 62 74 第一电离势 (KJ/mol) 1402 1011.8 859.7 833.7 703.3 第一电子亲和 势(KJ/mol) -7 71.7 77 101 100 电负性 3.04 2.19 2.18 2.05 2.02
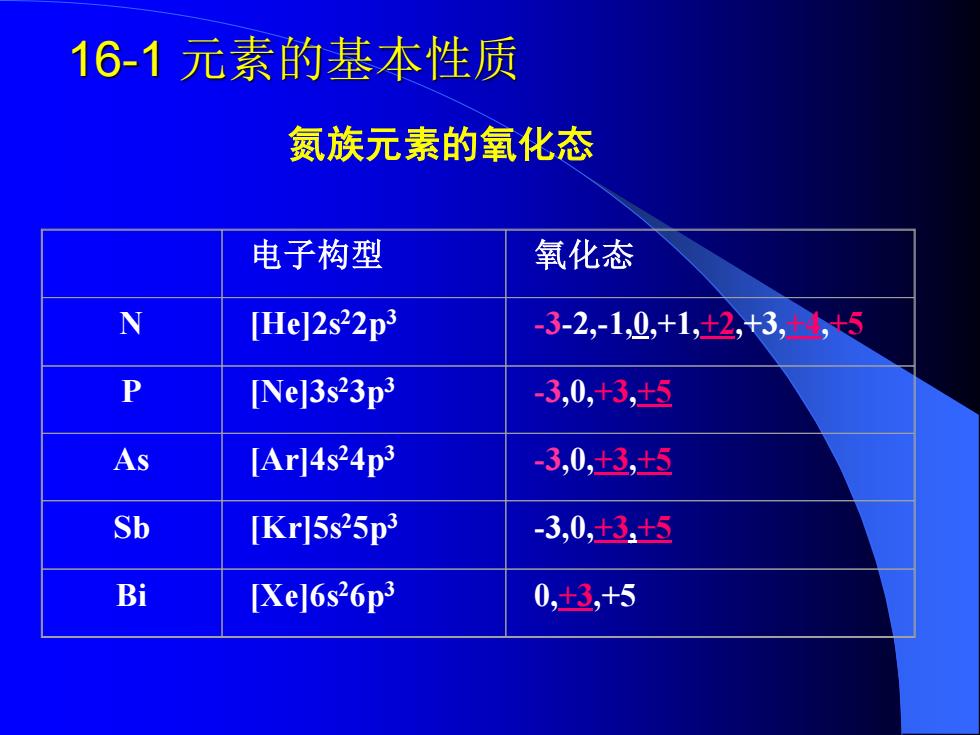
16-1元素的基本性质 氨族元素的氧化态 电子构型 氧化态 N [He]2s22p3 -3-2,-1,0+1,+2,t3,+4+5 P [Ne]3s23p3 -3,0,+3,+5 As [Ar]4s24p3 -3,0+3,+5 Sb [Kr]5s25p3 -3,0+3t5 Bi [Xe]6s26p3 0,+3,+5
氮族元素的氧化态 电子构型 氧化态 N [He]2s 22p 3 -3-2,-1,0,+1,+2,+3,+4,+5 P [Ne]3s 23p 3 -3,0,+3,+5 As [Ar]4s 24p 3 -3,0,+3,+5 Sb [Kr]5s 25p 3 -3,0,+3,+5 Bi [Xe]6s 26p 3 0,+3,+5 16-1 元素的基本性质

16-1元素的基本性质 >氮族元素的特性 由于价电子层为ns2np3与氧族、卤素比较, 它们若要获得三个电子而形成Ⅲ价的离子是 较困难的,只有电负性较大的N、P能形成极 少数-Ⅲ价的离子型化合物,LiN、MgN2 NaP、Ca3P2等,由于N3-、P3-离子半径大容易 变型,遇水强烈水解生成NH3和PH3如: Mg3N2+6H2O==3Mg(OH)2+3NH3T Na3P+3H2O===3NaOH+3PH3T 本族元素形成正价的趋势较强,如N3、 PBrs、AsFs、SbCl5、BiCl3、SbCl等,形成共 价化合物是本族元素的特征
➢ 氮族元素的特性 由于价电子层为ns2np3与氧族、卤素比较, 它们若要获得三个电子而形成-Ⅲ价的离子是 较困难的,只有电负性较大的N、P能形成极 少数-Ⅲ价的离子型化合物,Li3N、Mg3N2、 Na3P、Ca3P2等,由于N3-、P3-离子半径大容易 变型,遇水强烈水解生成NH3和PH3如: Mg3N2+6H2O===3Mg(OH)2+3NH3 Na3P+3H2O===3NaOH+3PH3 本族元素形成正价的趋势较强,如NF3、 PBr5、AsF5、SbCl5、BiCl3、SbCl3等,形成共 价化合物是本族元素的特征。 16-1 元素的基本性质

16-1元素的基本性质 从N到Bi,+V氧化态的稳定性递减,而+Ⅲ氧化态的稳 定性递增。 +V氧化态的氮是较强的氧化剂。除氮外从磷到铋+V 氧化态的氧化性(从+V还原到+Ⅲ)依次增强。 +V氧化态的磷儿乎不具有氧化性并且最稳定,而+V 氧化态的铋是最强的氧化剂,它的+Ⅲ氧化态最稳定,几 乎不显还原性
16-1 元素的基本性质 从N到Bi,+V氧化态的稳定性递减,而+Ⅲ氧化态的稳 定性递增。 +V氧化态的氮是较强的氧化剂。除氮外从磷到铋+V 氧化态的氧化性(从+V还原到+Ⅲ)依次增强。 +V氧化态的磷儿乎不具有氧化性并且最稳定,而+V 氧化态的铋是最强的氧化剂,它的+Ⅲ氧化态最稳定,几 乎不显还原性