
4.诱导反应 在实际工作中,住往遇到一些在一般情况下不进行或进行很慢的 反应,由于另外一个反应的进行,而以较快的速度进行。一个反 应的发生促进另一个反应进行的现象,称为诱导反应。例如: 2Mm04+10C1-+16H+=2Mn2++5Cl2+8H20 反应很慢 由于下述反应而显著加快 受诱体 受诱反应 MnO4+5Fe2++16Ht=2Mn2++5Fe3++8H20 作用体 诱导体 诱导反应 注意诱导反应和催化反应的区别: 诱导反应 诱导体参与反应变为其他物质 催化反应 催化剂参与反应恢复到原来的状态 Analytical Chemistry
Analytical Chemistry 11 4. 诱导反应 在实际工作中,往往遇到一些在一般情况下不进行或进行很慢的 反应,由于另外一个反应的进行,而以较快的速度进行。一个反 应的发生促进另一个反应进行的现象,称为诱导反应。例如: 2MnO 10Cl 16H 2Mn 5Cl 2 8H2 O 2 4 + + = + + − − + + 反应很慢 由于下述反应而显著加快 MnO 5Fe 16H 2Mn 5Fe 8H2 O 2 2 3 4 + + = + + − + + + + 受诱反应 诱导反应 作用体 诱导体 受诱体 注意诱导反应和催化反应的区别: 诱导反应 诱导体参与反应变为其他物质 催化反应 催化剂参与反应恢复到原来的状态
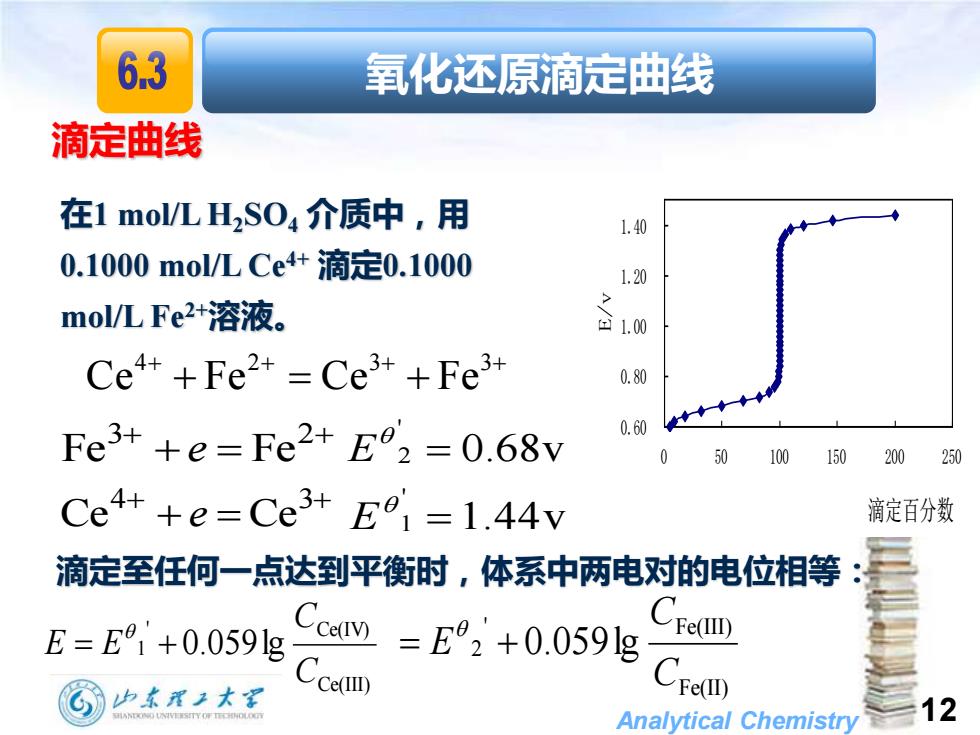
63 氧化还原滴定曲线 滴定曲线 在1mol/LH2S04介质中,用 1.40 0.1000mol/LCe4+滴定0.1000 1.20 mol/LFe2+溶液。 回1.00 Ce++Fe2+=Ce3++Fe3+ 0.80 Fe3++e=Fe2+E°2=0.68v 0.60 50 100150200250 Ce4++e=Ce3+E01=1.44v 滴定百分数 滴定至任何一点达到平衡时,体系中两电对的电位相等 E=E1+0.0591g aV)=+0.059g Cse四 少东理2大军 Cc. Cse四 Analytical Chemistry 12
Analytical Chemistry 12 滴定曲线 在1 mol/L H2SO4 介质中,用 0.1000 mol/L Ce4+ 滴定0.1000 mol/L Fe2+溶液。 + + + = 3 2 Fe e Fe 0.68v ' 2 = E + + + = 4 3 Ce e Ce 1.44v ' 1 = E 滴定至任何一点达到平衡时,体系中两电对的电位相等: Ce(III) ' Ce(IV) 1 0.059lg C C E = E + Fe(II) ' Fe(III) 2 0.059lg C C = E + 0.60 0.80 1.00 1.20 1.40 0 50 100 150 200 250 滴定百分数 E/v + + + + + = + 4 2 3 3 Ce Fe Ce Fe 氧化还原滴定曲线

滴定过程中电势的计算 1、滴定前: 空气氧化产生少量的Fe3+,组成Fe3+Fe2+电对,但cc3+未知, 故不可算 2、化学计量点前: 有剩余的Fe2+,故用Fe3+Re2+电对计算溶液电位。 当加入Ce4+19.98mL时(滴定分数0.999) +0.059 C=0.68+0.059g 9.98×0.1000 0.02×0.1000 =0.86 能否用Ce4+/Ce3+电对计算? Analytical Chemistry 13
Analytical Chemistry 13 1、滴定前: 空气氧化产生少量的Fe3+ ,组成Fe3+/Fe2+电对,但 cFe3+未知, 故不可算 滴定过程中电势的计算 2、化学计量点前: 有剩余的Fe2+ ,故用Fe3+/Fe2+电对计算溶液电位。 当加入Ce4+ 19.98mL时(滴定分数0.999) 0.86 0.02 0.1000 19.98 0.1000 0.68 0.059lg C C 0.059lg 2 3 3 2 Fe Fe Fe /Fe 0 = = + = + + + + + E E 能否用Ce4+/Ce3+电对计算?