
第二章 水分与冰 4.水的比热较大。所以,水温不易随气温而变化。 5.水的介电常数高。20℃时水的介电常数是80.36。而大多数生 物体的干物质的介电常数为2.2~4.0。在理论上,任何物质, 其水分含量增加1%,介电常数将增加近0.8。由于水的介电常 数大,故能促进电解质的电离。 6.水的溶解能力强。a.溶解离子型化合物的能力较强;b.非离 子极性化合物如糖类、醇类、醛类、酮类等有机物质亦均可 与水形成氢键而溶于水中;c即使不溶于水的物质,如脂肪 和某些蛋白质,也能在适当的条件下分散在水中,形成乳浊 液或胶体溶液
第二章 水分与冰 4. 水的比热较大。所以,水温不易随气温而变化。 5. 水的介电常数高。20℃时水的介电常数是80.36。而大多数生 物体的干物质的 介电常数为 2.2~4.0。在理论上,任何物质, 其水分含量增加1%,介电常数将增加近0.8。由于水的介电常 数大,故能促进电解质的电离。 6. 水的溶解能力强。a.溶解离子型化合物的能力较强;b.非离 子极性化合物如糖类、醇类、醛类、酮类等有机物质亦均可 与水形成氢键而溶于水中;c.即使不溶于水的物质,如脂肪 和某些蛋白质,也能在适当的条件下分散在水中,形成乳浊 液或胶体溶液
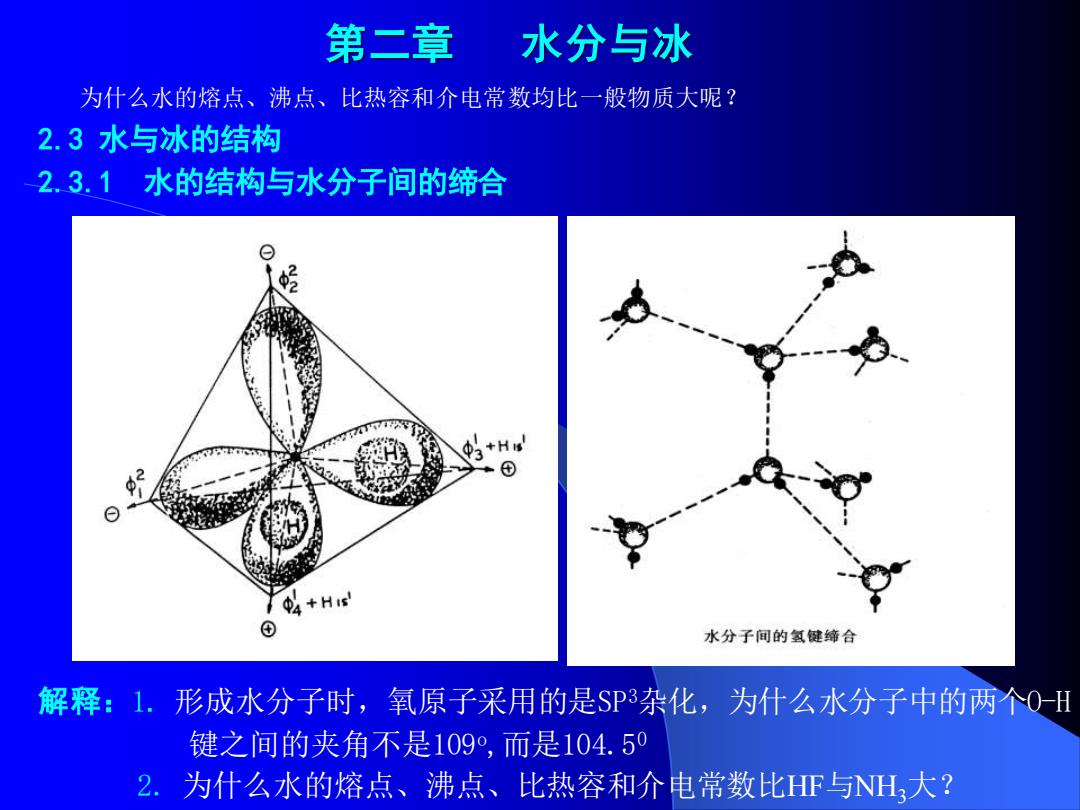
第二章 水分与冰 为什么水的熔点、沸点、比热容和介电常数均比一般物质大呢? 2.3水与冰的结构 2.3.1水的结构与水分子间的缔合 +His' ⊙ 水分子间的氢健缔合 解释:1.形成水分子时,氧原子采用的是SP3杂化,为什么水分子中的两个0H 键之间的夹角不是109°,而是104.50 2.为什么水的熔点、沸点、比热容和介电常数比HF与NH大?
第二章 水分与冰 为什么水的熔点、沸点、比热容和介电常数均比一般物质大呢? 2.3 水与冰的结构 2.3.1 水的结构与水分子间的缔合 解释:1. 形成水分子时,氧原子采用的是SP3杂化,为什么水分子中的两个O-H 键之间的夹角不是109o ,而是104.50 2. 为什么水的熔点、沸点、比热容和介电常数比HF与NH3大?
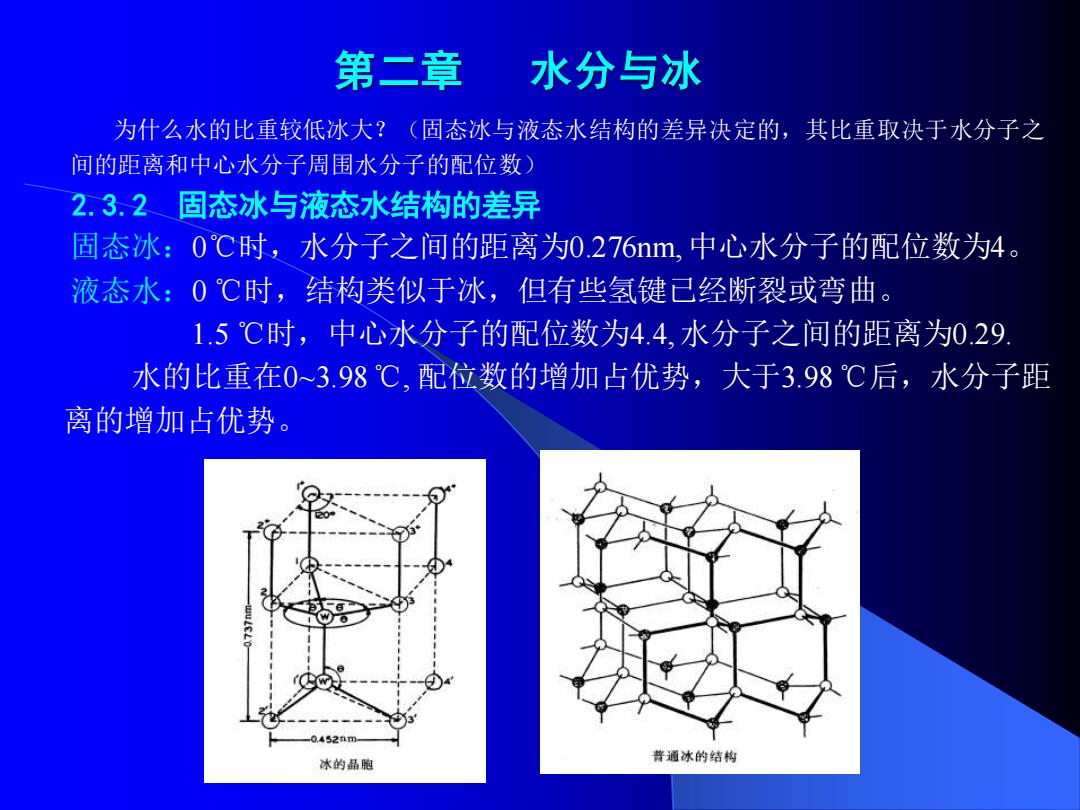
第二章 水分与冰 为什么水的比重较低冰大?(固态冰与液态水结构的差异决定的,其比重取决于水分子之 间的距离和中心水分子周围水分子的配位数) 2.3,2固态冰与液态水结构的差异 固态冰:0℃时,水分子之间的距离为0.276nm,中心水分子的配位数为4。 液态水:0℃时,结构类似于冰,但有些氢键已经断裂或弯曲。 1.5℃时,中心水分子的配位数为4.4,水分子之间的距离为0.29 水的比重在0~3.98℃,配位数的增加占优势,大于3.98℃后,水分子距 离的增加占优势。 452m 冰的品胞 普通冰的结构
第二章 水分与冰 为什么水的比重较低冰大?(固态冰与液态水结构的差异决定的,其比重取决于水分子之 间的距离和中心水分子周围水分子的配位数) 2.3.2 固态冰与液态水结构的差异 固态冰:0℃时,水分子之间的距离为0.276nm, 中心水分子的配位数为4。 液态水:0 ℃时,结构类似于冰,但有些氢键已经断裂或弯曲。 1.5 ℃时,中心水分子的配位数为4.4, 水分子之间的距离为0.29. 水的比重在0~3.98 ℃, 配位数的增加占优势,大于3.98 ℃后,水分子距 离的增加占优势
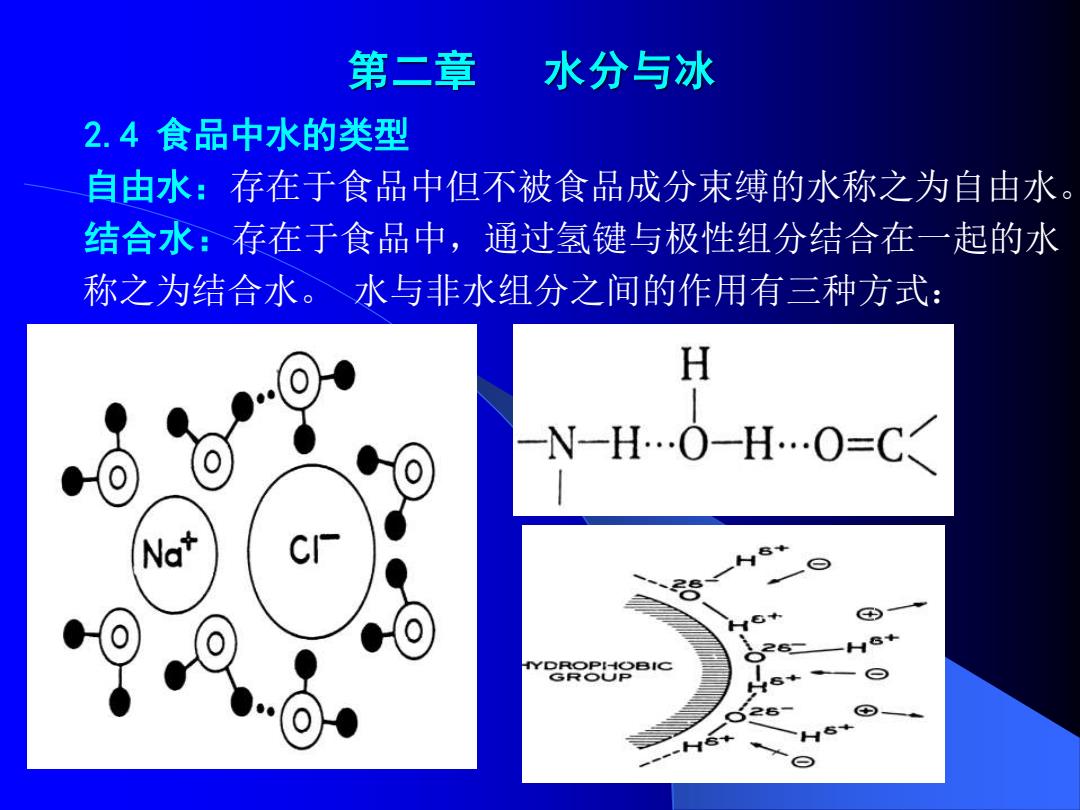
第二章 水分与冰 2.4食品中水的类型 自由水:存在于食品中但不被食品成分束缚的水称之为自由水。 结合水:存在于食品中,通过氢键与极性组分结合在一起的水 称之为结合水。水与非水组分之间的作用有三种方式: H N-H…O-H…O=C<
第二章 水分与冰 2.4 食品中水的类型 自由水:存在于食品中但不被食品成分束缚的水称之为自由水。 结合水:存在于食品中,通过氢键与极性组分结合在一起的水 称之为结合水。 水与非水组分之间的作用有三种方式: