
实验八乙酸乙酯皂化反应动力学研究 一、实验目的与要求 1、掌握化学动力学的某些概念。 2、测定乙酸乙酯皂化反应的速度常数。 3、熟悉电导率仪的使用方法」 二、预习要求 1、了解电导法测定化学反应速度常数的原理。 2、了解DDS-型电导率仪的使用方法。 三、实验原理: 乙酸乙酯皂化反应方程式为 CH;COOC:Hs+Na*+OH =CHsCOO+Na*+C:HsOH 在反应过程中,各物质的浓度随时间而改变(注:N离子在反应前后浓度不变)。若 乙酸乙酯的初始浓度为,氢氧化钠的初始浓度为b,当时间为1时,各生成物的浓度均为x, 此时刻的反应速度为: =k(a-xXb-x) dx (10-1) 式中,k为反应的速率常数,将上式积分可得: 如=a6hg 1 (10-2) 若初淡度9-0为会-,积分得 ki= a(a-x) (10-3) 不同时刻各物质的浓度可用化学分析法测出,例如分析反应中的O州浓度,也可用物 理法测量溶液的电导而求得。在本实验中我们采用后一种方法,即用电导法来测定。 电导是导体导电能力的量度,金属的导电是依靠自由电子在电场中运动来实现的,而电 解质溶液的导电是正、负离子向阳极、阴极迁移的结果,电导L是电阻R的倒数。 L=R= 式中A为导体的截面积,1为导体的长度,L,称电导率。它的物理意义是:当=m,m 时的电导。对一种金属,在一定温度下,Lg是一定的。对电解质溶液的Lg不仅与温度有关 而且与溶液中的离子浓度有关。在有多种离子存在的溶液中,L。是各种离子迁移作用的总 和,它与溶液中离子的数目,离子所带电荷以及离子迁移率有关。在本实验中,由于反应是 在较稀的水溶液中进行的,我们可以假定CHsCOONa全部电离,反应前后溶液中离子数目 和离子所带电荷不变, 由于CH:COO 的迁移率 O的迁移率小,随着反应的进行, OH 不断减少,CH,CO0的浓度不断增加,故体系电导率值会不断下降,在一定范围内,可以 认为体系的电导率的减少量和CHCOO的浓度x增加量成正比,在(时 x=K(Lo-L,) (10-4)
实验八 乙酸乙酯皂化反应动力学研究 一、实验目的与要求: 1、掌握化学动力学的某些概念。 2、测定乙酸乙酯皂化反应的速度常数。 3、 熟悉电导率仪的使用方法。 二、预习要求: 1、 了解电导法测定化学反应速度常数的原理。 2、 了解 DDS-型电导率仪的使用方法。 三、实验原理: 乙酸乙酯皂化反应方程式为: CH3COOC2H5+Na++OH- ══ CH3COO-+Na++C2H5OH 在反应过程中,各物质的浓度随时间而改变(注:Na+离子在反应前后浓度不变)。若 乙酸乙酯的初始浓度为 a,氢氧化钠的初始浓度为 b,当时间为 t 时,各生成物的浓度均为 x, 此时刻的反应速度为: dx dt = k(a − x)(b − x) (10-1) 式中,k 为反应的速率常数,将上式积分可得: kt a b b a x a b x = − − − 1 ln ( ) ( ) (10-2) 若初始浓度 a=b,9-(1)式变为 dx dt = k(a − x) 2 ,积分得: kt x a a x = ( − ) (10-3) 不同时刻各物质的浓度可用化学分析法测出,例如分析反应中的 OH-浓度,也可用物 理法测量溶液的电导而求得。在本实验中我们采用后一种方法,即用电导法来测定。 电导是导体导电能力的量度,金属的导电是依靠自由电子在电场中运动来实现的,而电 解质溶液的导电是正、负离子向阳极、阴极迁移的结果,电导 L 是电阻 R 的倒数。 L R L A l = = g 1 式中 A 为导体的截面积,l 为导体的长度,Lg 称电导率。它的物理意义是:当 l=1m,A=1m2 时的电导。对一种金属,在一定温度下,Lg 是一定的。对电解质溶液的 Lg 不仅与温度有关, 而且与溶液中的离子浓度有关。在有多种离子存在的溶液中,Lg 是各种离子迁移作用的总 和,它与溶液中离子的数目,离子所带电荷以及离子迁移率有关。在本实验中,由于反应是 在较稀的水溶液中进行的,我们可以假定 CH3COONa 全部电离,反应前后溶液中离子数目 和离子所带电荷不变,但由于 CH3COO-的迁移率比 OH-的迁移率小,随着反应的进行,OH -不断减少,CH3COO-的浓度不断增加,故体系电导率值会不断下降,在一定范围内,可以 认为体系的电导率的减少量和 CH3COO-的浓度 x 增加量成正比,在 t=t 时 x = K L − Lt ( ) 0 (10-4)

式中Lo为起始时的电导率,b,为1时的电导率。当时反应终了CHCO0的浓度为a a=K(L。-Ln) (10-5) 式中L即反应终了时的电导率,K为比例常数,将(4)、(5)代入(3)式得: K(Lo-L) (L-L,) 灶= akL。-L)-(L。-L,】a(L,-L. 或写成: 22-咖 (10-6) 或 Lo-L=akl,-aklo (10-7) t 从直线方程6可阳,只要测定T上以及组L值后,利用乞 对1作图,应得 直线,直线的斜率就是反应速度和初始浓度a的乘积。k的单位为dm3molrmi。 反应的活化能可根据阿累尼乌斯公式求算: dInk E dTRT (10-8) 积分得: (10-9) 式中、k分别对应于温度、的反应速率常数,R为气体常数,E。为反应的活化 能。 四、仪器与药品 DDS一型电导率仪 1台 电导池 1 恒温槽 1套 100mL恒温夹套反应器 1个 0.5mL移液管 1支 100mL移液管 1古 50mL的烧杯 1个 50mL滴定智 1古 250mL锥形瓶 秒表 1块 吸耳球 1只 CHsCOOC,H试剂(分析纯 NaOH(分析纯 酚酞指示剂溶液 五、实验步骤: 1、打开恒温槽使其恒温在25℃±0.2℃。 2、打开电导率仪。根据附录“电导率仪的使用”对电导率仪进行0点及满刻度校正 并认真检查所用电导电极的常数,并用旋钮调至所需的位置。 3、NaOH溶液的配制:(室温下) 用一个小烧杯配制少量的浓NaOH溶液,在1000ml的广口瓶装入约900ml的 蒸溜水,将所选用实验仪器的测量电极插入水中
式中 L0 为起始时的电导率,Lt 为 t 时的电导率。当 t=t时反应终了 CH3COO-的浓度为 a, 即: a = K L − L ( ) 0 (10-5) 式中 L即反应终了时的电导率,K 为比例常数,将(4)、(5)代入(3)式得: kt K L L aK L L L L L L a L L t t t t = − − − − = − − ( ) ( ) ( ) ( ) ( ) 0 0 0 0 或写成: L L L L akt t t 0 − − = (10-6) 或 = − − akL akL t L L t 0 t (10-7) 从直线方程(6)可知,只要测定了 L0、L以及一组 Lt 值后,利用 L L L L t t 0 − − 对 t 作图,应得 一直线,直线的斜率就是反应速度和初始浓度 a 的乘积。k 的单位为 dm3·mol-1·min-1。 反应的活化能可根据阿累尼乌斯公式求算: d k dT E RT a ln = 2 (10-8) 积分得: ln k k E R T T T T 2 a 1 2 1 1 2 = − (10-9) 式中 k1、k2 分别对应于温度 T1、T2 的反应速率常数,R 为气体常数,Ea 为反应的活化 能。 四、仪器与药品: DDS-型电导率仪 1 台 电导池 1 只 恒温槽 1 套 100mL 恒温夹套反应器 1 个 0.5mL 移液管 1 支 100mL 移液管 1 支 50mL 的烧杯 1 个 50mL 滴定管 1 支 250mL 锥形瓶 3 个 秒表 1 块 吸耳球 1 只 CH3COOC2H5 试剂(分析纯) NaOH(分析纯) 酚酞指示剂溶液 五、实验步骤: 1、打开恒温槽使其恒温在 25℃±0.2℃。 2、打开电导率仪。根据附录“电导率仪的使用”对电导率仪进行 0 点及满刻度校正。 并认真检查所用电导电极的常数,并用旋钮调至所需的位置。 3、NaOH 溶液的配制:(室温下) 用一个小烧杯配制少量的浓 NaOH 溶液,在 1000ml 的广口瓶装入约 900ml 的 蒸溜水,将所选用实验仪器的测量电极插入水中
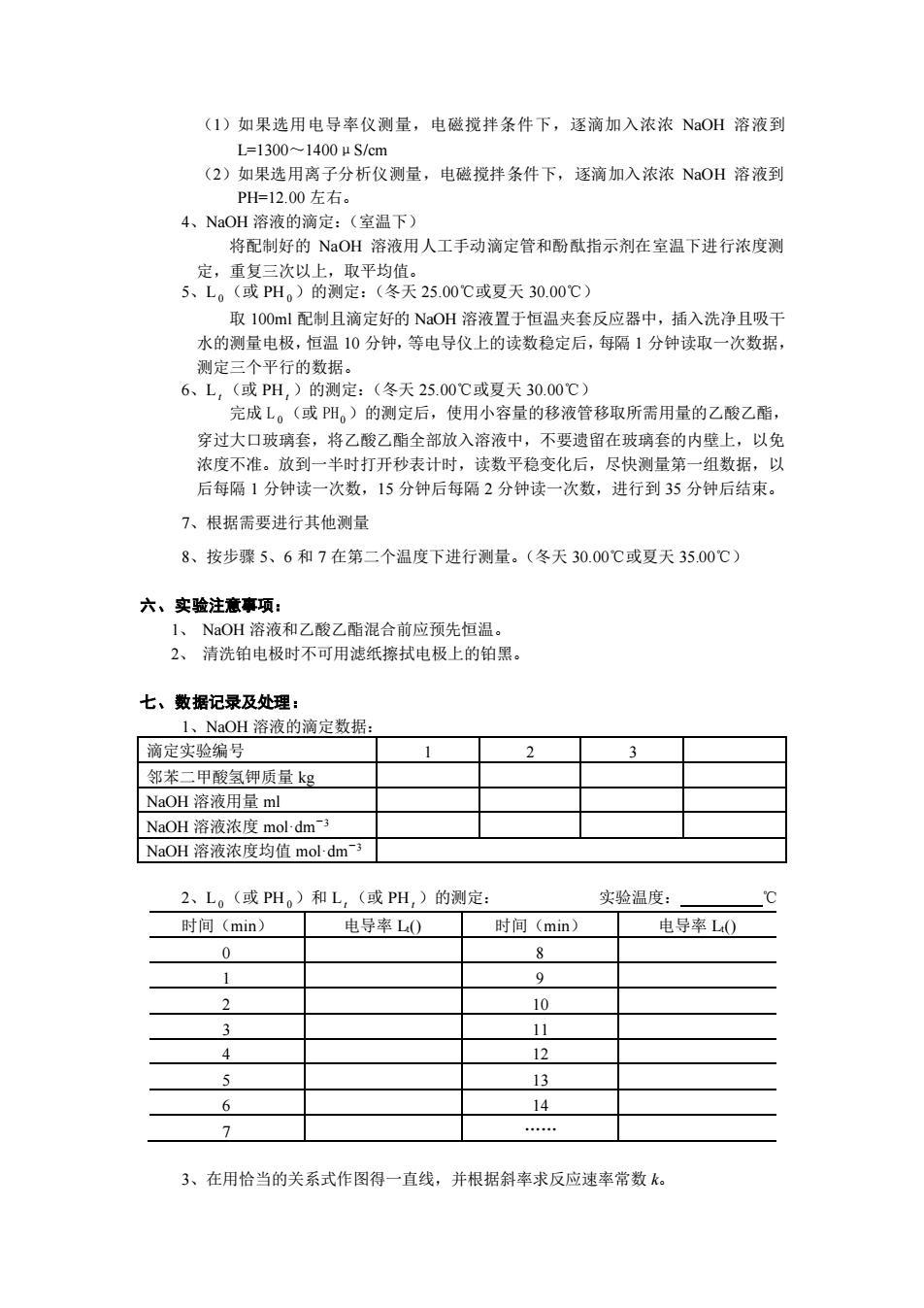
(1)如果选用电导率仪测量,电磁搅拌条件下,逐滴加入浓浓NaOH溶液到 L=1300-1400u3/cm (2)如果选用离子分析仪测量,电磁搅拌条件下,逐滴加入浓浓NaOH溶液到 PH=12.00左右。 4、NaOH溶液的滴定:(室温下) 将配制好的NaOH溶液用人工手动滴定管和酚酞指示剂在室温下进行浓度测 定,重复三次以上,取平均估 5、L。(或PH。)的测定:(冬天25.00℃或夏天30.00C) 取1O0ml配制且滴定好的NaOH溶液置于恒温夹套反应器中,插入洗净且吸干 水的测量电极,恒温10分钟,等电导仪上的读数稳定后,每1分钟读取一次数据, 测定三个平行的数据。 6、L,(或PH,)的测定:(冬天25.00℃或夏天30.00℃) 完成L。(或PH。)的测定后,使用小容量的移液管移取所需用量的乙酸乙酯, 穿过大口玻璃套,将乙酸乙酯全部放入溶液中,不要遗留在玻璃套的内壁上,以免 浓度不准。放到一半时打开秒表计时,读数平稳变化后,尽快测量第一组数据,以 后每隔1分钟读一次数,15分钟后每隔2分钟读一次数,进行到35分钟后结束。 7、根据需要进行其他测量 8、按步骤5、6和7在第二个温度下进行测量。(冬天30.00℃或夏天35.00C) 六、实验注意事项: NaOH溶液和乙酸乙酯混合前应预先恒温。 2、清洗铂电极时不可用滤纸擦拭电极上的铂黑。 七、数据记录及处理: 1。NaOH溶液的滴定新据 滴定实验编号 2 邻苯二甲酸氢钾质量kg NaOH溶液用量m NaOH溶液浓度mol-dm3 NaOH溶液浓度均值moldm 2、L。(或PH。)和L,(或PH,)的测定: 实验温度: 时间(min) 电导率L0时间(min) 申导率L0 0 8 9 10 12 13 14 3、在用恰当的关系式作图得一直线,并根据斜率求反应速率常数k
(1)如果选用电导率仪测量,电磁搅拌条件下,逐滴加入浓浓 NaOH 溶液到 L=1300~1400μS/cm (2)如果选用离子分析仪测量,电磁搅拌条件下,逐滴加入浓浓 NaOH 溶液到 PH=12.00 左右。 4、NaOH 溶液的滴定:(室温下) 将配制好的 NaOH 溶液用人工手动滴定管和酚酞指示剂在室温下进行浓度测 定,重复三次以上,取平均值。 5、L 0 (或 PH 0 )的测定:(冬天 25.00℃或夏天 30.00℃) 取 100ml 配制且滴定好的 NaOH 溶液置于恒温夹套反应器中,插入洗净且吸干 水的测量电极,恒温 10 分钟,等电导仪上的读数稳定后,每隔 1 分钟读取一次数据, 测定三个平行的数据。 6、L t (或 PH t )的测定:(冬天 25.00℃或夏天 30.00℃) 完成 L 0 (或 PH 0 )的测定后,使用小容量的移液管移取所需用量的乙酸乙酯, 穿过大口玻璃套,将乙酸乙酯全部放入溶液中,不要遗留在玻璃套的内壁上,以免 浓度不准。放到一半时打开秒表计时,读数平稳变化后,尽快测量第一组数据,以 后每隔 1 分钟读一次数,15 分钟后每隔 2 分钟读一次数,进行到 35 分钟后结束。 7、根据需要进行其他测量 8、按步骤 5、6 和 7 在第二个温度下进行测量。(冬天 30.00℃或夏天 35.00℃) 六、实验注意事项: 1、 NaOH 溶液和乙酸乙酯混合前应预先恒温。 2、 清洗铂电极时不可用滤纸擦拭电极上的铂黑。 七、数据记录及处理: 1、NaOH 溶液的滴定数据: 滴定实验编号 1 2 3 邻苯二甲酸氢钾质量 kg NaOH 溶液用量 ml NaOH 溶液浓度 mol·dm-3 NaOH 溶液浓度均值 mol·dm-3 2、L 0 (或 PH 0 )和 L t (或 PH t )的测定: 实验温度: ℃ 时间(min) 电导率 Lt() 时间(min) 电导率 Lt() 0 8 1 9 2 10 3 11 4 12 5 13 6 14 7 . 3、在用恰当的关系式作图得一直线,并根据斜率求反应速率常数 k

4、由,k0,根据阿累尼乌斯公式 求出反应的活化能Ea。 李贺应动力学研究有两个方面,分别为。 答 2.化学反应动力学的三个重要参数是什么?一般情况下哪一个参数应该先被 实验确定? 答: 化学反应级数:化学反应速率常数k:活化能a。一般情况下化学反应 级数n先被实验确定。 3.溶液均相化学反应实验研究的重要测量起点是: 答: 4.化学反应有快有慢,为了能准确测量出不断变化的物质浓度或物理量,动力 学试验中应该关注的三个重要时间概念是: 答: 5.对于动力学研究中,物理量及其测量仪器的选择有哪些方面的考虑: 答:(1)反应前后,体系的物理量的变化非常 2)测的物质浓度成线 (3)测的物质浓度不成线性关系的非特征物质量为最差。 6. 根据具有简单反应级数的化学反应动力学特征,大致有哪几种确定反应级数 费处积法半期法,改变初始物质浓度法。 ,一般情况下为什么要在恒温条件下进行? 的反应 而速率常教与温度有关,电导率的数值与 温度也有关,所以要准确进行动力学测量,必须在恒温条件下进行。 19年美人获满贝尔奖的铁美成就是 常规液体均相化学反应动力学实验研究 (以下内容由参考资料中的介绍摘要、整理、拼接而成,供参考,详细内容请看有关资料》 化学反应动力学研究的两个方面: (1)化学反应速率研究:(2)化学反应机理(或历程)研究
4、由 k25,k30,根据阿累尼乌斯公式 ln k k E R T T T T 2 a 1 2 1 1 2 = − 求出反应的活化能 Ea。 八、思考题: 1. 化学反应动力学研究有两个方面,分别为: 答: 2. 化学反应动力学的三个重要参数是什么?一般情况下哪一个参数应该先被 实验确定? 答: 化学反应级数 n;化学反应速率常数 k;活化能 Ea。一般情况下化学反应 级数 n 先被实验确定。 3. 溶液均相化学反应实验研究的重要测量起点是: 答: 4. 化学反应有快有慢,为了能准确测量出不断变化的物质浓度或物理量,动力 学试验中应该关注的三个重要时间概念是: 答:. 5. 对于动力学研究中,物理量及其测量仪器的选择有哪些方面的考虑: 答:(1)反应前后,体系的物理量的变化非常显著; (2)测的物质浓度成线性关系的特征物质量为最佳; (3)测的物质浓度不成线性关系的非特征物质量为最差。 6. 根据具有简单反应级数的化学反应动力学特征,大致有哪几种确定反应级数 的数据处理方法? 答:微分法,积分法,半衰期法,改变初始物质浓度法。 7. 动力学实验,一般情况下为什么要在恒温条件下进行? 答:不同温度下的反应速度不一样,反应速率常数与温度有关,电导率的数值与 温度也有关,所以要准确进行动力学测量,必须在恒温条件下进行。 8. 1999 年,美国人 A.H.Zewail 获诺贝尔奖的获奖成就是: 答: 飞秒激光技术研究超快化学反应过程和过渡态。 附: 常规液体均相化学反应动力学实验研究 (以下内容由参考资料中的介绍摘要、整理、拼接而成,供参考,详细内容请看有关资料) 化学反应动力学研究的两个方面: (1)化学反应速率研究;(2)化学反应机理(或历程)研究

化学反应速率研究的起点: 就是测 一条物质浓度随时间的变化曲线或与物质浓度有明确关系的物理量随时 间的变化曲线: 物质浓度的测量 化学法 物理法 测量方法: 直接测量 间接测量 与浓度的关系: 线性关系为最佳 测量的便利性: 间欺性测量 连续性测量 获得数据的方式: 称重或滴定 仪表直接读数 获得数据所需时间! ~10分钟 2秒 物理量间区别: 物质特征物理量测定 体系整体物理量测定 需要用排除法,要测量反应前无 物理量间测量区别 算公式或工作曲线 (/或)反应平衡后的体系物理量 三个重要的时间概念 化学反应有快有慢,有的极快,也有的极慢,针对不同的情况,就需要使用不同的实验 方法和测量仪器。因此在选用实验方法和测量仪器时,就要考虑到常规液相反应动力学 实验研究中三个需要注意的重要时间概念 1、化学反应诱导时间 )可能有下列情况: (1)两种以上物质混合后化学反应才能进行,从混合开始到体系混合均匀一致所需要 的时间: (2)化学反应由物理的声、光、电、磁、和各种射线等外场激发后进行,从物理激发 到化学反应开始所需要的时间。 2、数据测量时间tm (m)可能有下列情况: (1)实验测量仪器的响应时间:仪器的传感器或敏感元件从溶剂转移到被测物质浓度 较大的溶液中时,仪器给出稳定可靠数据所需要的时间 (2)从正在进行的化学反应体系中取出一部分,让其中的化 学反应停止,从操作开始 到化学反应完全停止(物质浓度不再随时间变化)所需要的时间。 3、化学反应时间(通常取物质浓度的半衰期以) 按照化学计量式,物质含量相对最少的那种物质在反应后消耗掉一半所需要的时间 为了能够在实验中测量到可靠、准确、误差小的动力学数据,以上三个时间之间 必需满足如下的条件: t⅓》0, t⅓》tm)
化学反应速率研究的起点: 就是测量一条物质浓度随时间的变化曲线或与物质浓度有明确关系的物理量随时 间的变化曲线。 物质浓度的测量 化学法 物理法 测量方法: 直接测量 间接测量 与浓度的关系: —— 线性关系为最佳 测量的便利性: 间歇性测量 连续性测量 获得数据的方式: 称重或滴定 仪表直接读数 获得数据所需时间: ~10分钟 ~2秒 物理量间区别: —— 物质特征物理量测定 体系整体物理量测定 物理量间测量区别: —— 计算公式或工作曲线 需要用排除法, 要测量反应前和 (/或)反应平衡后的体系物理量 三个重要的时间概念: 化学反应有快有慢,有的极快,也有的极慢,针对不同的情况,就需要使用不同的实验 方法和测量仪器。因此在选用实验方法和测量仪器时,就要考虑到常规液相反应动力学 实验研究中三个需要注意的重要时间概念: 1、 化学反应诱导时间 t(i) t(i)可能有下列情况: (1) 两种以上物质混合后化学反应才能进行,从混合开始到体系混合均匀一致所需要 的时间; (2) 化学反应由物理的声、光、电、磁、和各种射线等外场激发后进行,从物理激发 到化学反应开始所需要的时间。 2、 数据测量时间 t(m) t(m)可能有下列情况: (1) 实验测量仪器的响应时间:仪器的传感器或敏感元件从溶剂转移到被测物质浓度 较大的溶液中时,仪器给出稳定可靠数据所需要的时间; (2) 从正在进行的化学反应体系中取出一部分,让其中的化学反应停止,从操作开始 到化学反应完全停止(物质浓度不再随时间变化)所需要的时间。 3、 化学反应时间(通常取物质浓度的半衰期 t 2 1 ) 按照化学计量式,物质含量相对最少的那种物质在反应后消耗掉一半所需要的时间。 为了能够在实验中测量到可靠、准确、误差小的动力学数据,以上三个时间之间 必需满足如下的条件: t 2 1 》t(i) , t 2 1 》t(m)