
第四拿 酸碱滴定法 第一节) 概述 >酸碱滴定法(中和滴定法): 以酸碱反应(水溶液中的质子转移反应)为 基础的定量分析法 酸度” 决定各反应物的存在型体,影响物 质 蓝中的分布和平衡 (1)酸碱平衡理论 (2) 各类酸碱溶液的pH值计算方法 (3)各类酸碱滴定曲线和指示剂的选择
第四章 酸碱滴定法 第一节 概述 ➢ 酸碱滴定法(中和滴定法): 以酸碱反应(水溶液中的质子转移反应)为 基础的定量分析法 “酸度” 决定各反应物的存在型体,影响物 质 本章重点: 在溶液中的分布和平衡 (1)酸碱平衡理论 (2)各类酸碱溶液的pH值计算方法 (3)各类酸碱滴定曲线和指示剂的选择

第二节水溶液中的酸碱平衡 。酸碱质子理论 。溶剂合质子 。酸碱反应的实质 。溶剂的质子自递反应及其常数 酸碱强度的计算
第二节 水溶液中的酸碱平衡 o 酸碱质子理论 o 溶剂合质子 o 酸碱反应的实质 o 溶剂的质子自递反应及其常数 o 酸碱强度的计算

酸碱的定义 > 酸 电离理论∫ 能电离出H+的物质 碱 电离出OH的物质 电子理论 酸 凡能接受电子的物质 碱 凡能给出电子的物质 质子理论酸 —凡能给出质子的物质 碱—一凡能接受质子的物质
酸碱的定义 ➢ 电离理论 ➢ 电子理论 ➢ 质子理论 酸——能电离出H+的物质 碱——电离出OH-的物质 酸——凡能接受电子的物质 碱——凡能给出电子的物质 酸——凡能给出质子的物质 碱——凡能接受质子的物质

一、酸碱质子理论 酸一溶液中凡能给出质子的物质 碱一—溶液中凡能接受质子的物质 例子 特点: 1)具有共轭性 如:HA兰 A一+H 2)具有相对性 如:HCO,一既为酸, 也为碱(两性) 3)具有广泛性 如:HO中性分子,既可为酸,也可为碱 继续
一、酸碱质子理论 酸——溶液中凡能给出质子的物质 碱——溶液中凡能接受质子的物质 例子 特点: 1)具有共轭性 2)具有相对性 3)具有广泛性 如:HA A- + H+ HCO3 如: -既为酸,也为碱 (两性) 如:H2O 中性分子,既可为酸,也可为碱 继续
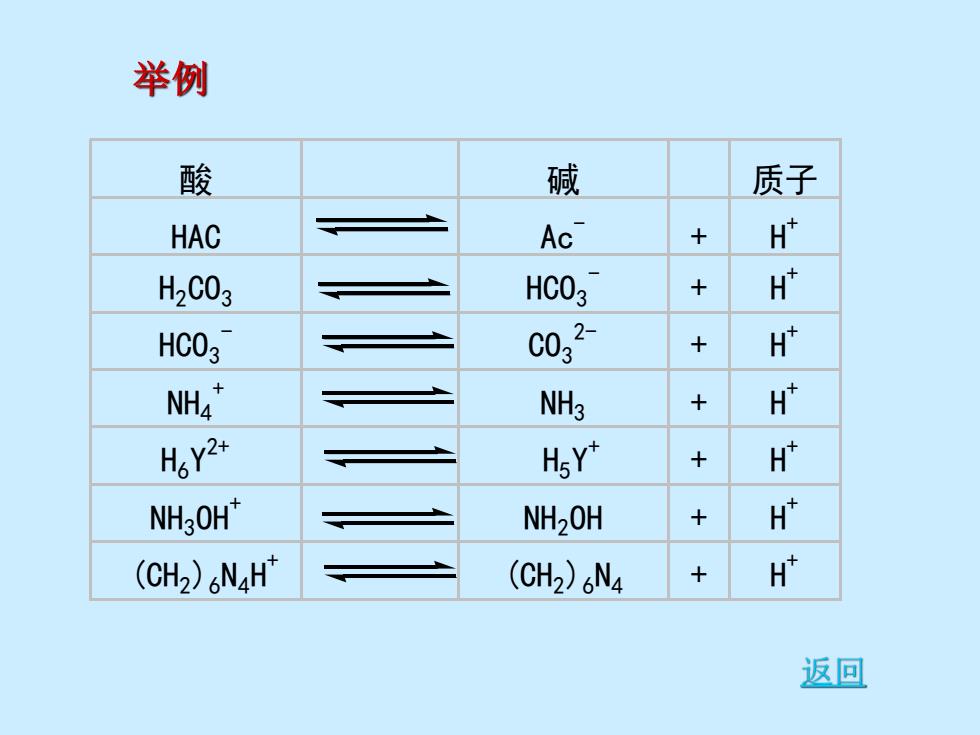
举例 酸 碱 质子 HAC Ac + H H2C03 HCO37 + H HCO3 c032 + H NH4" NH3 H H6Y2+ H5Y" + H NHgOH* NH2OH H (CHz)NaH" (CH2)6N4 H 返回
酸 碱 质子 HAC Ac- + H + H2 CO3 HCO3 - + H + HCO3 - CO3 2- + H + NH4 + NH3 + H + H6 Y 2+ H5 Y + + H + NH3 OH+ NH2 OH + H + (CH2 )6 N4 H + (CH2 )6 N4 + H + 举例 返回