
摩尔电导率A:在相距1m的两平行电极之间,放置含有1mo1 电解质的溶液的电导。摩尔电导率与电导率K的关系为: c:电解质溶液的物质的量浓度,单位为mol.m3 摩尔电导率1n的单位为:S.m2moll 表示电解质的摩尔电导率时,应标明电解质的基本单元。如: A,so,减as0, 显然: A(Na.SO,)-2A[Na.SO
c Λm = ( ) m 2 4 m Na2 SO4 2 1 Λ Na SO 或Λ c :电解质溶液的物质的量浓度,单位为 mol.m-3 摩尔电导率Λm的单位为:S.m-2.mol-1 表示电解质的摩尔电导率时,应标明电解质的基本单元。如: ( ) m 2 4 = m Na2 SO4 2 1 Λ Na SO 2Λ 摩尔电导率Λm:在相距1m 的两平行电极之间,放置含有1mol 电解质的溶液的电导。摩尔电导率与电导率 的关系为: 显然:
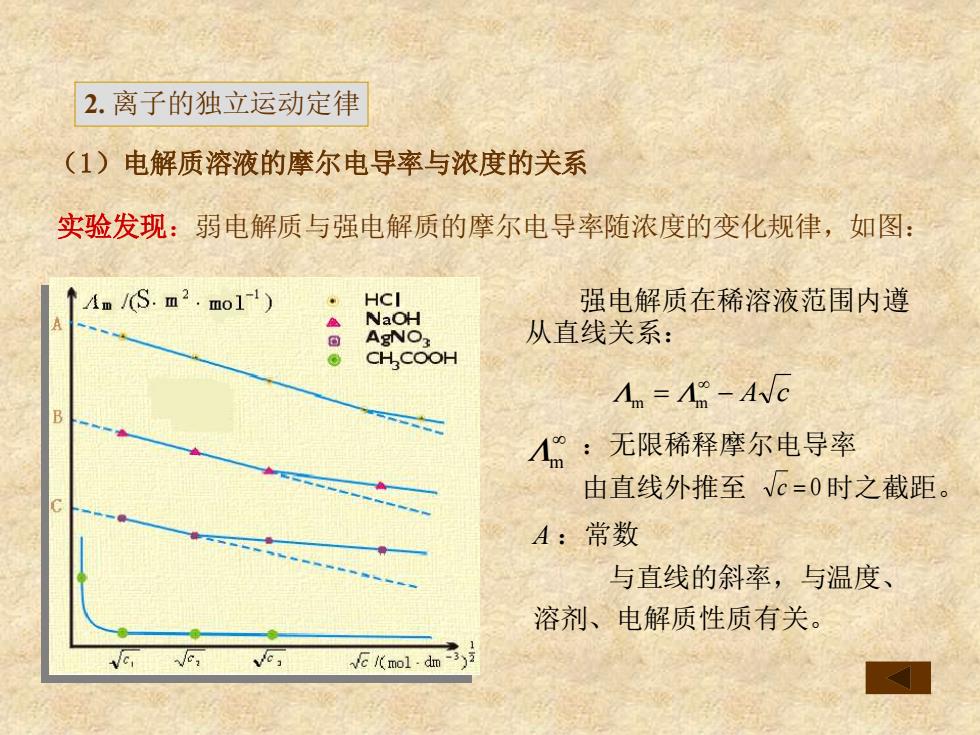
2.离子的独立运动定律 (1)电解质溶液的摩尔电导率与浓度的关系 实验发现:弱电解质与强电解质的摩尔电导率随浓度的变化规律,如图: ↑4m/S.m2.mo11) HCI 强电解质在稀溶液范围内遵 NaOH AgNO3 从直线关系: CH COOH Am=Am-AVc B A:无限稀释摩尔电导率 由直线外推至c=0时之截距。 A:常数 与直线的斜率,与温度、 溶剂、电解质性质有关。 emoldn
(1)电解质溶液的摩尔电导率与浓度的关系 实验发现:弱电解质与强电解质的摩尔电导率随浓度的变化规律,如图: 强电解质在稀溶液范围内遵 从直线关系: :无限稀释摩尔电导率 由直线外推至 时之截距。 A :常数 与直线的斜率,与温度、 溶剂、电解质性质有关。 = − A c Λm Λm Λm c = 0 2. 离子的独立运动定律

(2)Kohlrausch离子独立运动定律 在无限稀释溶液中,离子彼此独立运动,每种离子对A”的贡献不受其 他离子存在的影响,电解质的A可以认为是正、负离子摩尔电导率之和。 数学表达式:离子独立运动定律可写为: A=vAm+vAm 对1一1型电解质:=++4 +,“分别表示:在无限稀释溶液中,正、负离子的摩尔电导率。 应用:根据离子独立运动定律,可以利用强电解质无限稀释摩 尔电导率来计算弱电解质无限稀释摩尔电导率
(2) Kohlrausch离子独立运动定律 在无限稀释溶液中,离子彼此独立运动,每种离子对 的贡献不受其 他离子存在的影响,电解质的 可以认为是正、负离子摩尔电导率之和。 数学表达式:离子独立运动定律可写为: 对 1—1 型电解质: 分别表示:在无限稀释溶液中,正、负离子的摩尔电导率。 应用:根据离子独立运动定律,可以利用强电解质无限稀释摩 尔电导率来计算弱电解质无限稀释摩尔电导率。 Λm − − + + Λm = Λm, + Λm, − + Λm =Λm, +Λm, , m, Λ + Λm,− Λm

3.离子的电迁移率与离子的摩尔电导率 电解质溶液的导电能力,由两电极间溶液中所含离子数日、离子 价数以及离子在电场中的运动速率来决定。 (1)离子在电场中的运动速率 离子的电迁移率:单位电场强度下离子的运动速率。用符号U,U表示 正、负离子的电迁移率。它是表征离子在电场中的运动速率的物理量。 02 04,v.表示正、负离子的运动速率(单位:m.s1) E:电场强度(单位:Vm) 正、负离子电迁移率U,U的单位为:m2v1s1 离子的电迁移率是表征离子在电场中迁移的基本参数,是离子的特性。 离子的电迁移现象演示
电解质溶液的导电能力,由两电极间溶液中所含离子数目、离子 价 数以及离子在电场中的运动速率来决定。 (1)离子在电场中的运动速率 离子的电迁移率:单位电场强度下离子的运动速率。用符号U+ ,U-表示 正、负离子的电迁移率。它是表征离子在电场中的运动速率的物理量。 υ+ ,υ- :表示正、负离子的运动速率(单位:m.s-1) E :电场强度(单位:V.m-1) 正、负离子电迁移率U+ ,U-的单位为:m-2.v -1.s -1 离子的电迁移率是表征离子在电场中迁移的基本参数,是离子的特性。 E υ U + + = E υ U − − = 3. 离子的电迁移率与离子的摩尔电导率 离子的电迁移现象演示

阳极区中间区 阴极区 离子电迁移现象 园
离子电迁移现象