
三、基本概念 电极反应(electrode reaction) 电极上进行的有电子得失的化学反应 电池反应(electric cell reaction) 两个电极反应组成一个电池反应 正极:电位高 阳极:氧化反应 负极:电位低 阴极:还原反应
三、基本概念 电极反应(electrode reaction) 电极上进行的有电子得失的化学反应 电池反应(electric cell reaction) 两个电极反应组成一个电池反应 正极:电位高 阳极:氧化反应 负极:电位低 阴极:还原反应

例 电解池:电解CuCl2溶液 原电池:丹尼尔(Daniell)电池 阴极(-)Cu2+2e→Cu 阳极(-)Zn→Zn2+2e 阳极(+)2C-2e→Cl2 阴极(+)Cu2++2eCu 电池反应:Cu2+2C→Cu+CL2 电池反应:Zn+Cu2+→Zn2+Cu 丹尼尔(Daniell)电池演示
例 电解池:电解CuCl2溶液 阴极(-)Cu2++2e-→Cu 阳极(+)2Cl- -2e-→Cl2 电池反应:Cu2++ 2Cl-→Cu+ Cl2 原电池:丹尼尔(Daniell)电池 阳极(-)Zn→Zn2++2e- 阴极(+)Cu2++2e-→Cu 电池反应: Zn+ Cu2+ →Zn2++Cu 丹尼尔(Daniell)电池演示
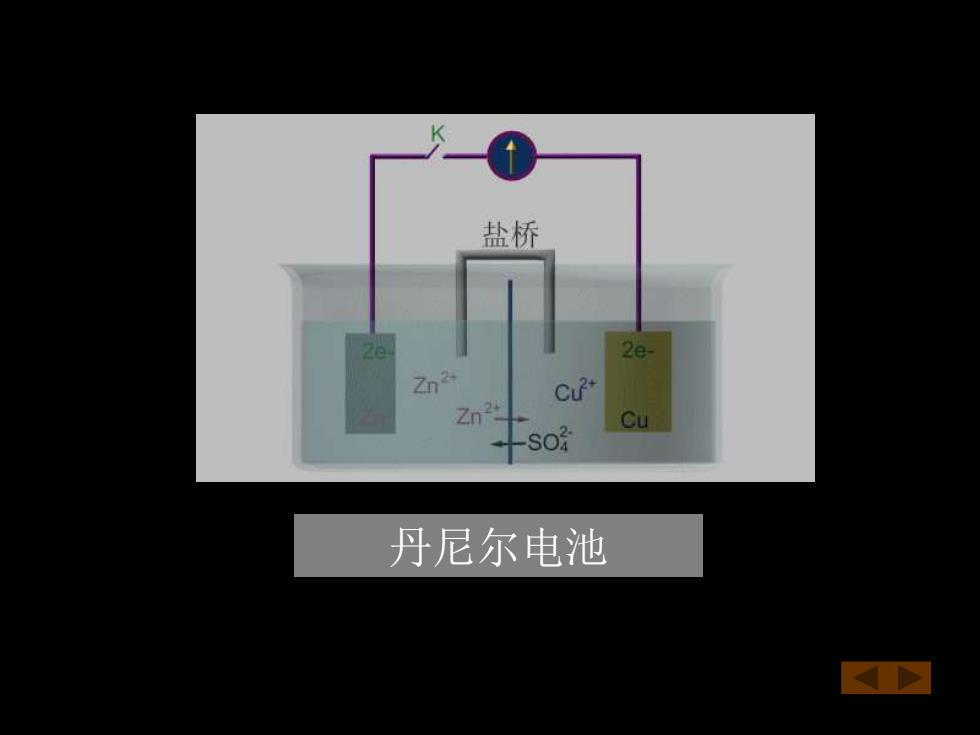
盐桥 2e- Zn2 Zn2 Cu 丹尼尔电池 ☒
丹尼尔电池

四.法拉第(Faraday)定律 对不同的电解质溶液,每通过lol电子电量,在任一电极上发生 得失1mol电子的电极反应,同时与得失1mol电子相对应的任一电极 反应的物质的量为lmol。 1mol电子电量=Le=96485.309C/mol=F(法拉第常数)
对不同的电解质溶液,每通过1mol 电子电量,在任一电极上发生 得失1mol 电子的电极反应,同时与得失1mol 电子相对应的任一电极 反应的物质的量为1mol 。 1mol 电子电量=L·e =96485.309 C/mol =F (法拉第常数) 四. 法拉第(Faraday)定律

§9-2电解质溶液的导电性质 Electrolyte solutions and electrochemistry 1.电导率K与摩尔电导率△m 电解质溶液的电导:电阻(R)的导数,单位为Q1或S“西门子” 1S=121 1 G= R 电导率《:置于单位面积(A)的两平行电极中,且电极距离() 为单位长度时,电解质溶液的电导。单位为Sm G-KT K-GA
电解质溶液的电导:电阻(R)的导数,单位为Ω-1或S“西门子”, 1S= 1Ω-1 电导率κ: 置于单位面积(A)的两平行电极中,且电极距离(l) 为单位长度时,电解质溶液的电导。单位为S/m § 9-2 电解质溶液的导电性质 Electrolyte solutions and electrochemistry R G 1 = l A G = A l = G 1.电导率κ与摩尔电导率Λm