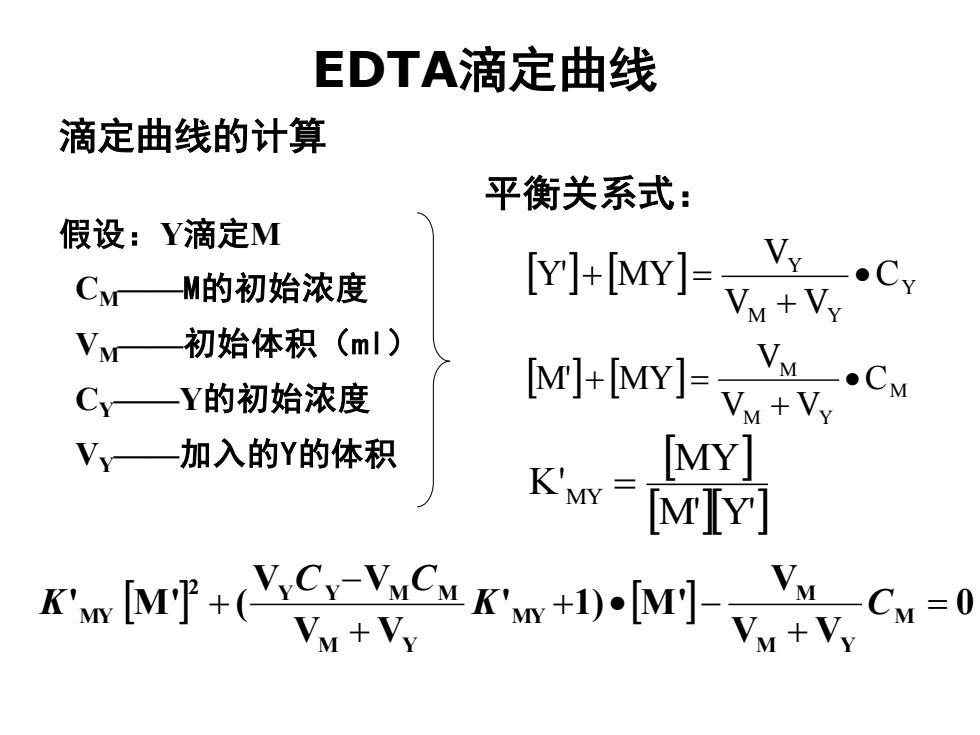
EDTA滴定曲线 滴定曲线的计算 平衡关系式: 假设:Y滴定M CM—M的初始浓度 [Y]+[MYJ-W.cy Vm+Vy 初始体积(ml) Cy—Y的初始浓度 [M]+IMY]-C 加入的Y的体积 K's= MY MIY] KmF+(SCun+-、 Vy+Vy CM=0
EDTA滴定曲线 假设:Y滴定M CM——M的初始浓度 VM——初始体积(ml) CY——Y的初始浓度 VY——加入的Y的体积 M'Y' MY K'MY = 滴定曲线的计算 M M Y M C V V V M' MY • + + = Y M Y Y C V V V Y' MY • + + = 平衡关系式: 0 V V V ' 1) M ' V V V V ' M ' ( M M Y M MY M Y 2 Y Y M M MY = + + • − + − + K C C C K

用EDTA溶液0.02000molL1滴定相同浓度的Zn2+, 溶液pH=9。 1.滴定前 溶液中只有待测金属离子存在 [Zn']=czn-0.02000mol L-1 p[Zn]=1.70
1. 滴定前 溶液中只有待测金属离子存在 [Zn']= cZn=0.02000mol·L-1 用EDTA溶液0.02000mol·L-1滴定相同浓度的Zn2+ , 溶液pH=9。 p[Zn']=1.70

2.滴定开始至计量点前 p[Zn]由未被滴定的[Zn所决定 c 当加入EDTA19.98mL时 n]-VVCm ×20.00mol●L V +Vy 20.00+19.98)mL pZn'=5.00
2. 滴定开始至计量点前 p[Zn']由未被滴定的[Zn']所决定 Zn Zn Y Zn Y C V V V V Zn' • + − = 当加入EDTA19.98mL时 ( ) ( ) pZn 5.00 20.00mol L 20.00 19.98 mL 20.00 -19.98 mL C V V V V Zn' 1 Zn Zn Y Zn Y = • + • = + − = −

3.计量点 溶液中的[Zn]来自络合物ZnY2的解离 [Znlp=[Y'p ZnY CZn.sp Kay=2n'TY]In'E znl。= CZn,sp pin'-+
3. 计量点 溶液中的[Zn']来自络合物ZnY2-的解离 ( ) Zn,s p ZnY ZnY Zn,s p s p 2 s p Zn,s p ZnY s p s p pc lgK 2 1 pZn K c Zn Zn c Zn Y ZnY K Zn' Y = + = = = =

4.计量点后 过量的EDTA一致了络合物ZnY2的解离,所以[Zn] 与过量的EDTA浓度有关 [Zn]-V-V.cm Van+Vy [Y]-V-V.ex Va+Vx [ZnY] [zm]= pZn'-(leKy)-IE VyV
4. 计量点后 过量的EDTA一致了络合物ZnY2-的解离,所以[Zn'] 与过量的EDTA浓度有关 Y Zn Y Y Zn Zn Zn Y Zn Y c V V V V Y c V V V V Zn' • + − = • + − = ( ) Y Zn Zn ZnY ZnY V V V pZn lgK lg Y K ZnY Zn − = − =