
■例2:Na2HPO4溶液 得失质子数示意图: Ho +H* HPO:+H* H2O -H"ON- HPO+2H* HPO -H'PO [Ht]+[H2PO4]+2IH3PO4=[OH]+[PO43-] H3PO4是零水准HPO42得2个质子后的产物, 晶所以[H3PO4前应乘以2,才能保持得失质子的 量(mol)相等
▪ 例2:Na2HPO4溶液 ▪ 得失质子数示意图: ▪ [H+ ]+[H2PO4 -]+ 2[H3PO4]=[ OH- ]+[PO4 3- ] ▪ H3PO4是零水准HPO4 2-得2个质子后的产物, 所以[H3PO4]前应乘以2,才能保持得失质子的 量(mol)相等
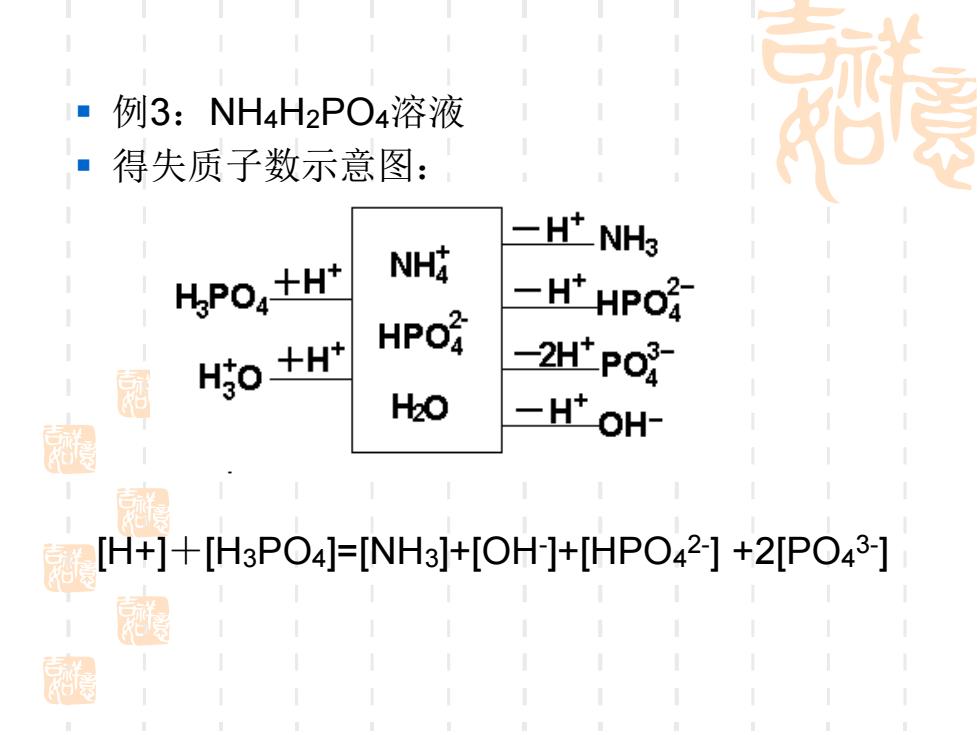
■例3:NH4H2PO4溶液 ·得失质子数示意图: 一HtNH3 HPO,+H' NH HPO子 =H'HPO经 属 HO +H' -2H'PO H2O 图 一HtoH [H+]+[H3PO4]=[NH3]+[OH]+[HPO42]+2[PO,3] 淘
▪ 例3:NH4H2PO4溶液 ▪ 得失质子数示意图: [H+]+[H3PO4]=[NH3]+[OH- ]+[HPO4 2- ] +2[PO4 3- ]

■例4:HAc(C1)+NaAc (C2) a.若选H2O,HAc为零水准 则[H+]=[OH]+[AC]-C2 b.若选H2O,AC为零水准 则[H]+[HAC]-C1=[OH] 例5.H3PO4的PK~PK,分别为2.12、7.20、 12.36,若用NaOH滴定H3PO4至PH=9.0时,溶 液中大量存在的为HPO42-,应选HPO42-、H2O 为零水准 [H+]+[H2PO4-]+2[H3PO4]=[OH]+[PO43-]
▪ 例4:HAc(C1)+NaAc(C2) ▪ a.若选H2O ,HAc为零水准 ▪ 则[H+ ]=[ OH- ]+[ AC- ]-C2 ▪ b.若选H2O,AC-为零水准 ▪ 则[H+ ]+[HAC] -C1=[ OH- ] ▪ 例5.H3PO4的 ~ 分别为2.12、7.20、 12.36,若用NaOH滴定H3PO4至PH=9.0时,溶 液中大量存在的为HPO42-,应选HPO4 2-、H2O 为零水准 ▪ [H+]+[H2PO4 -]+ 2[H3PO4]=[ OH- ]+[PO4 3- ] PK a1 PK a3

例6:NaOH,NH3,H3PO4等摩尔混合时的PBE式 NH3+H3PO4+OH-=NH4++HPO42-+H2O 选用NH4+、HPO42-、H2O为零水准,PBE为 [H+]+[H2PO4-]+2[H3PO4]=[NH3]+[OH]+[PO43-] 二.PH的计算 1. 强酸强碱溶液 强酸(碱)在溶液中全部离解,故在一般情况 下,酸度的计算比较简单 例如0.10 mol/LHC溶液pH=1.00 吉 但当强酸(碱)浓度C<10-6mol/L,则溶液的 酸度除需考虑酸(碱)离解出来的H+(OH)之 外,还要考虑水离解出来的H(OH)
例6: NaOH,NH3,H3PO4等摩尔混合时的PBE式 NH3+H3PO4+OH-=NH4 ++HPO4 2-+H2O 选用NH4+ 、HPO4 2-、H2O为零水准,PBE为 [H+]+[H2PO4 -]+ 2[H3PO4]=[ NH3]+[ OH- ]+[PO4 3- ] 二. PH的计算 1.强酸强碱溶液 强酸(碱)在溶液中全部离解,故在一般情况 下,酸度的计算比较简单 例如 0.10mol/LHCl溶液 pH=1.00 ▪ 但当强酸(碱)浓度C<10-6mol/L,则溶液的 酸度除需考虑酸(碱)离解出来的 ( )之 外,还要考虑水离解出来的 ( )。 H + OH − OH − H +

■对于浓度为C的强酸溶液 ■PBE为:[H]一C=[OH] (1】 Kx+C [H+] 精确式[H]2-C[H+]-Km=0(4-10) ★分析化学中计算酸度时允许RE约为5%,即当 主要组分的浓度大于次要组分浓度的20倍以上时, 次要组分可忽略。 由(1)式,当C≥20[OH时,可以忽略[OH) 得最简式: [H*]=C
▪ 对于浓度为C的强酸溶液 ▪ PBE为: -C= (1) ▪ 精确式 (4-10) ▪ ★分析化学中计算酸度时允许RE约为5%,即当 主要组分的浓度大于次要组分浓度的20倍以上时, 次要组分可忽略。 ▪ 由(1)式,当C≥20 时,可以忽略 , 得最简式: ▪ ≈C [ ] H + [ ] OH − [ ] [ ] K w H C H + + = + 2 [ ] [ ] 0 H C H Kw + + − − = [ ] OH − [ ] OH − [ ] H +