
例如:浓度为C的HAc溶液 P ·C=[HAc]+[AcT] 例如:2×103mo/LCu(NO3)2和0.2mol/LNH3混合 溶液的MBE式 解:有三个MBE式: [NO3-]=4×10-3mo/L (Cu2+)=[Cu2+]+[Cu(NH3+.+[Cu(NH3)4] 2=2×10-3mo/L C(NH3)=[NH3]+[NH4]+[Cu(NH3)]+2[Cu(NH3)2]. +4[Cu(NH3)4]=0.2mol/L
例如: 浓度为C的HAc溶液 ▪ C=[HAc]+[Ac-] 例如:2×10-3mol/L Cu(NO3)2和0.2mol/LNH3混合 溶液的MBE式 解:有三个MBE式: [NO3- ]=4×10-3mol/L (Cu2+ )=[Cu2+]+[Cu(NH3)]+.+[ Cu(NH3)4] =2×10-3mol/L C(NH3)=[ NH3]+[ NH4 + ]+[ Cu(NH3)]+2[ Cu(NH3)2]. .+4[ Cu(NH3)4]=0.2mol/L

2.电荷平衡式(Charge Balance Equation,cBE) (P38) 任何电解质溶液必须是电中性的,即单位体积 溶液中阳离子所带正电荷的量(mo)应等于阴离 子所带负电荷的量(mo)。 例:浓度为C的Na2CO3 ·[Na]+[H]=2[CO32-]+[HCO3]+[OH] ★等式两边同乘以体积,便是物质的量。 ★其中[Na]=C ★H2CO3是中性分子,不包括在CBE中
2.电荷平衡式 (Charge Balance Equation,CBE) (P38) ▪ 任何电解质溶液必须是电中性的,即单位体积 溶液中阳离子所带正电荷的量(mol)应等于阴离 子所带负电荷的量(mol)。 例:浓度为C的Na2CO3 ▪ [Na+ ]+[H+ ]=2[CO3 2-]+[ HCO3 -]+[OH-] ▪ ★等式两边同乘以体积,便是物质的量。 ▪ ★其中[Na+ ]=C ▪ ★H2CO3是中性分子,不包括在CBE 中

3.质子平衡式 (质子条件式,Proton Balance Equation,PBE)(P39) 酸碱反应的实质是质子的转移,当反应达到平 衡时,酸失去的质子数(或量(o))与碱得到 的质子数〔或量(mol))必相等。 列质子条件式时,必须选定质子参考水准(零 水准),并以此作为水准来考虑质子的得失。通常 选择溶液中大量存在并参与质子转移的物质作为零 水准(一般就是原始的酸碱组分)
3.质子平衡式 (质子条件式,Proton Balance Equation , PBE)(P39) 酸碱反应的实质是质子的转移,当反应达到平 衡时,酸失去的质子数〔或量(mol)〕与碱得到 的质子数〔或量(mol)〕必相等。 列质子条件式时,必须选定质子参考水准(零 水准),并以此作为水准来考虑质子的得失。通常 选择溶液中大量存在并参与质子转移的物质作为零 水准(一般就是原始的酸碱组分)
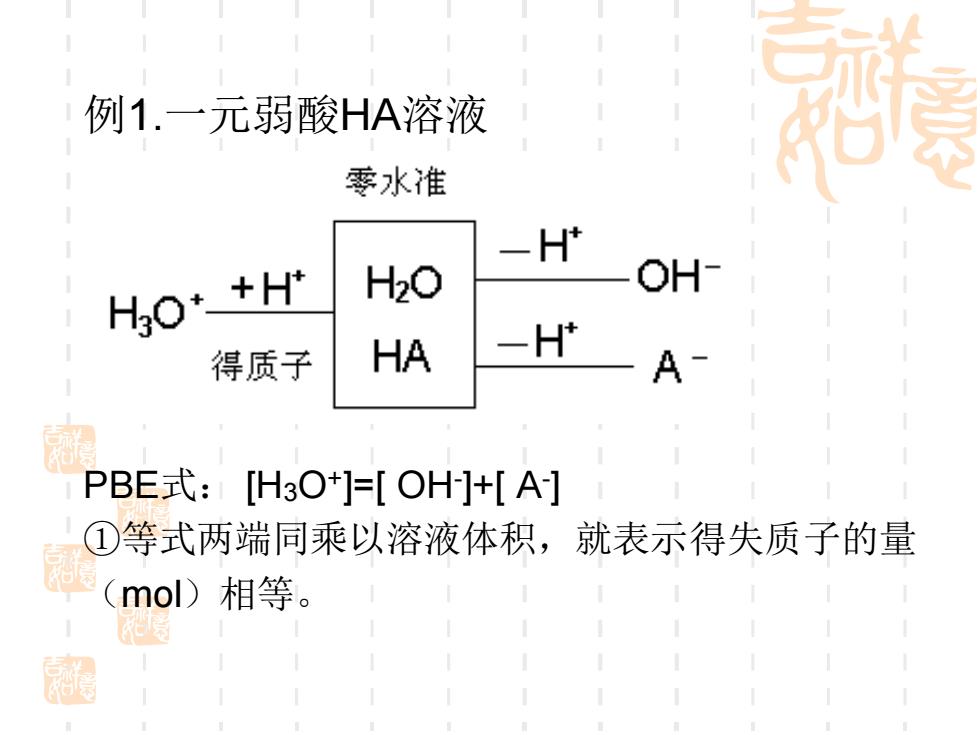
例1.一元弱酸HA溶液 要水准 -H' Ho*+H H2O OH 得质子 HA -H A PBE式:[H3O]=[OH]+[A] ①等式两端同乘以溶液体积,就表示得失质子的量 和 (mol)相等
例1.一元弱酸HA溶液 PBE式: [H3O+ ]=[ OH- ]+[ A- ] ①等式两端同乘以溶液体积,就表示得失质子的量 (mol)相等

②在选好零水准后,将溶液中其他酸碱组分与其相 比较,把所有得质子后产物的浓度的总和写在等 式一端,所有失质子后产物的浓度的总和写在等 式另一端,即得到PBE ③PBE式中不出现零水准物质 例1:HA+a(molL)的HCl 溶液中[H3O+]有3个来源:一是零水准H2O,另一 是HC离解而得(因HC是100%离解,所以不能 作为零水准),则零水准得质子数=[H3O]一a, 吉 由零水准得失质子数相等可得: [H+]-a=[OH]+[A]
②在选好零水准后,将溶液中其他酸碱组分与其相 比较,把所有得质子后产物的浓度的总和写在等 式一端,所有失质子后产物的浓度的总和写在等 式另一端,即得到PBE ③PBE式中不出现零水准物质 例1:HA + a(mol/L)的HCl ▪ 溶液中[H3O+ ]有3个来源:一是零水准H2O,另一 是HCl离解而得(因HCl是100%离解,所以不能 作为零水准),则零水准得质子数=[H3O+ ]-a, 由零水准得失质子数相等可得: ▪ [H+]-a=[ OH- ]+[ A- ]