
)当元素的氧化数为最高值时,它的氧化数不能 再增大,只能做氧化剂。 如Cr,O22-、MnO4是常用的氧化剂。 (2)当元素的氧化数为最低值时,它的氧化数不能 再减小,只能做还原剂。 如$2、【是常用的还原剂。 (3)当元素的氧化数为中间值时,它既可以做 氧化剂,也可以做还原剂。如:I有时是氧化剂 ,有时是还原剂
(1)当元素的氧化数为最高值时,它的氧化数不能 再增大,只能做氧化剂。 如Cr2O7 2-、MnO4 -是常用的氧化剂。 (2)当元素的氧化数为最低值时,它的氧化数不能 再减小,只能做还原剂。 如S 2-、I -是常用的还原剂。 (3)当元素的氧化数为中间值时,它既可以做 氧化剂,也可以做还原剂。如:I 2有时是氧化剂 ,有时是还原剂

氧化还原反应方程式的配平 氧化数法 氧化数升降平衡 离子电子配平:得失电子数相等 配平原则: ①电荷守恒:氧化剂得电子数等于还原剂 失电子数。 ②质量守恒:反应前后各元素原子总数相 等
配平原则: ① 电荷守恒:氧化剂得电子数等于还原剂 失电子数。 ② 质量守恒:反应前后各元素原子总数相 等。 氧化还原反应方程式的配平 氧化数法 氧化数升降平衡 离子电子配平:得失电子数相等

配平步骤: ①用离子式写出主要反应物和产 物(气体、纯液体、固体和弱电解质测 写分子式)。 ②分别写出氧化剂被还原和还原 剂被氧化的半反应。 ③分别配平两个半反应方程式, 等号两边的各种元素的原子总数各自 相等且电荷数相等
配平步骤: ①用离子式写出主要反应物和产 物(气体、纯液体、固体和弱电解质则 写分子式)。 ②分别写出氧化剂被还原和还原 剂被氧化的半反应。 ③分别配平两个半反应方程式, 等号两边的各种元素的原子总数各自 相等且电荷数相等

④确定两半反应方程式得、失电子数目 的最小公倍数。将两个半反应方程式中各项 分别乘以相应的系数,使得、失电子数目相 同。然后,将两者合并,就得到了配平的氧 化还原反应的离子方程式。有时根据需要可 将其改为分子方程式。 例1:配平反应方程式 KMnO(aq)+K2SO;(aq) 酸性溶液中MnSO,(aq)+K2SO,(aq)
例1:配平反应方程式 MnSO (aq) K SO (aq) KMnO (aq) K SO (aq) 4 2 4 酸性溶液中 4 2 3 ⎯⎯ ⎯→ + + ④确定两半反应方程式得、失电子数目 的最小公倍数。将两个半反应方程式中各项 分别乘以相应的系数,使得、失电子数目相 同。然后,将两者合并,就得到了配平的氧 化还原反应的离子方程式。有时根据需要可 将其改为分子方程式
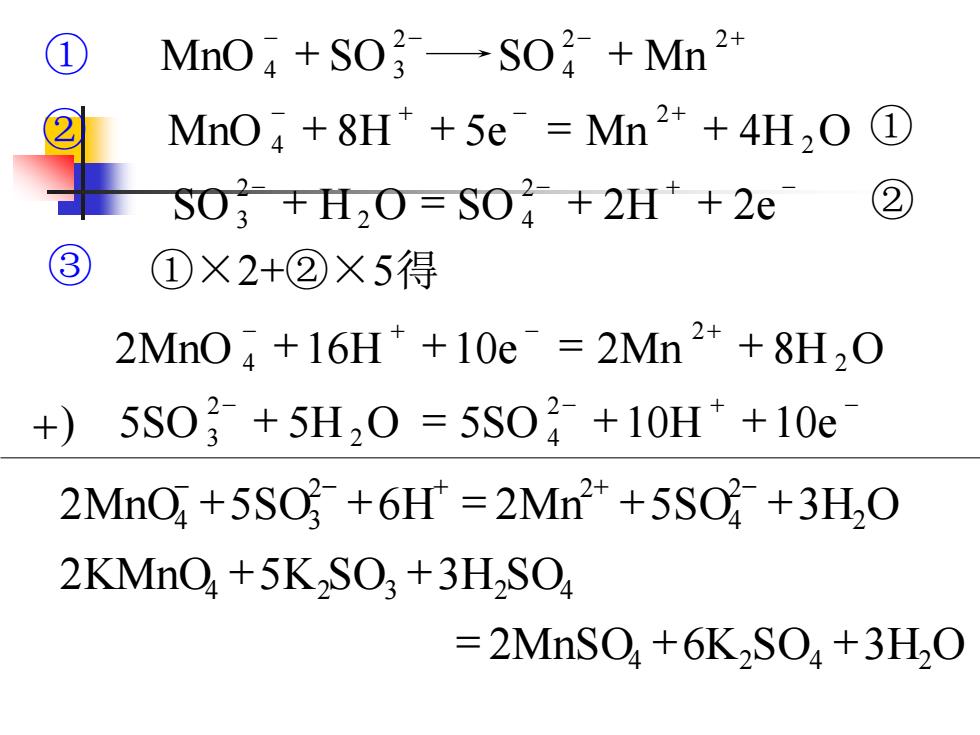
MnO4+S0}→S0+Mn2+ MnO+8H*+5e Mn2*+4H,O 1 S03+H20=S0}+2H++2e 2 3 ①X2+②X5得 2Mn04+16H+10e=2Mn2++8H20 +) 5S0?+5H,0=5S0?+10H++10e 2MnO +5SO +6H*2Mn*+5SO +3H,O 2KMnO+5K2SO3 +3H2SO =2MnS04+6K2S04+3H,0
+) 2 4 − − + − 5SO + 5H O = 5SO + 10H +10e 2 2 3 − + − + 2MnO + 16H + 10e = 2Mn + 8H 2O 2 4 − + − + ② MnO + 8H + 5e = Mn + 4H 2O 2 4 ① − − + − SO + H O = SO + 2H + 2e 2 2 4 2 3 ② ③ ①×2+②×5得 = 2MnSO4 +6K2SO4 +3H2O 2MnO 5SO 6H 2Mn 5SO 3H2O 2 4 2 2 4 3 + + = + + − − + + − − − − + ① MnO + SO SO + Mn 2 2 4 2 4 3 2KMnO4 5K SO3 3H SO2 4 + + 2