
上页 下页 目录 返回 晶格能可以通过各种 方法计算得到(本课程不 要求),最常用的有以下 几种方法: ● 波恩-哈勃循环 ● 玻恩-兰达公式 ● 水合能循环法 U H S I D E H S I D E U = − + + + − = + + + − + − 2 1 ( ) ( ) 2 1 θ f θ f
上页 下页 目录 返回 晶格能可以通过各种 方法计算得到(本课程不 要求),最常用的有以下 几种方法: ● 波恩-哈勃循环 ● 玻恩-兰达公式 ● 水合能循环法 U H S I D E H S I D E U = − + + + − = + + + − + − 2 1 ( ) ( ) 2 1 θ f θ f

上页 下页 目录 返回 卤化物 实验值 计算值 最佳值 (热化学循环 ) (波恩-兰达公式) LiF LiCl LiBr LiI NaF NaCl NaBr NaI KF KCl KBr KI 1033 845.2 797.9 739.7 915.0 788.0 739.3 692.0 813.4 708.8 679.5 640.2 1004 840.1 781.2 718.4 914.2 770.3 728.4 680.7 812.1 701.2 671.1 632.2 1008 811.3 766.1 708.4 902.0 755.2 718.8 663.2 797.5 687.4 659.8 623.0 碱金属卤化物的晶格能 Lattice energy
上页 下页 目录 返回 卤化物 实验值 计算值 最佳值 (热化学循环 ) (波恩-兰达公式) LiF LiCl LiBr LiI NaF NaCl NaBr NaI KF KCl KBr KI 1033 845.2 797.9 739.7 915.0 788.0 739.3 692.0 813.4 708.8 679.5 640.2 1004 840.1 781.2 718.4 914.2 770.3 728.4 680.7 812.1 701.2 671.1 632.2 1008 811.3 766.1 708.4 902.0 755.2 718.8 663.2 797.5 687.4 659.8 623.0 碱金属卤化物的晶格能 Lattice energy

上页 下页 目录 返回 (4) 离子极化 (ionic polarization) ●分子中原子的核外电子受电场的作用,电子云发 生变形,这种现象称为极化。 ●离子自身也受其他离子电场的作用,也可以发 生极化,其结果都是使电子云变形,并使正离子和负 离子之间产生了额外的吸引力。 ●负离子的半径一般较大,外壳上有较多的电子,易于 被诱导,变形性大。通常研究离子间的相互作用时,一 般考虑正离子的极化作用和负离子的变形性。 ◆极化和变形
上页 下页 目录 返回 (4) 离子极化 (ionic polarization) ●分子中原子的核外电子受电场的作用,电子云发 生变形,这种现象称为极化。 ●离子自身也受其他离子电场的作用,也可以发 生极化,其结果都是使电子云变形,并使正离子和负 离子之间产生了额外的吸引力。 ●负离子的半径一般较大,外壳上有较多的电子,易于 被诱导,变形性大。通常研究离子间的相互作用时,一 般考虑正离子的极化作用和负离子的变形性。 ◆极化和变形

上页 下页 目录 返回 ●极化作用的强弱 影响极化作用的强弱因素决定 于离子的半径、电荷和电子构型。离子电荷愈高、 半径愈小,极化作用愈强。正离子的电子层结构对 极化作用也有影响。 ◆极化作用和变形性 ●变形性的大小 离子的半径愈大,变形性愈大。变 形性也与电子构型有关,外层具有9~17个电子的离 子变形性比稀有气体构型的要大得多。 ●附加极化作用 负离子被极化后,在一定程度上 增强了负离子对正离子的极化作用, 结果正离子变 形被极化,正离子被极化后,又增加了它对负离子 的极化作用。这种加强的极化作用称为附加极化
上页 下页 目录 返回 ●极化作用的强弱 影响极化作用的强弱因素决定 于离子的半径、电荷和电子构型。离子电荷愈高、 半径愈小,极化作用愈强。正离子的电子层结构对 极化作用也有影响。 ◆极化作用和变形性 ●变形性的大小 离子的半径愈大,变形性愈大。变 形性也与电子构型有关,外层具有9~17个电子的离 子变形性比稀有气体构型的要大得多。 ●附加极化作用 负离子被极化后,在一定程度上 增强了负离子对正离子的极化作用, 结果正离子变 形被极化,正离子被极化后,又增加了它对负离子 的极化作用。这种加强的极化作用称为附加极化
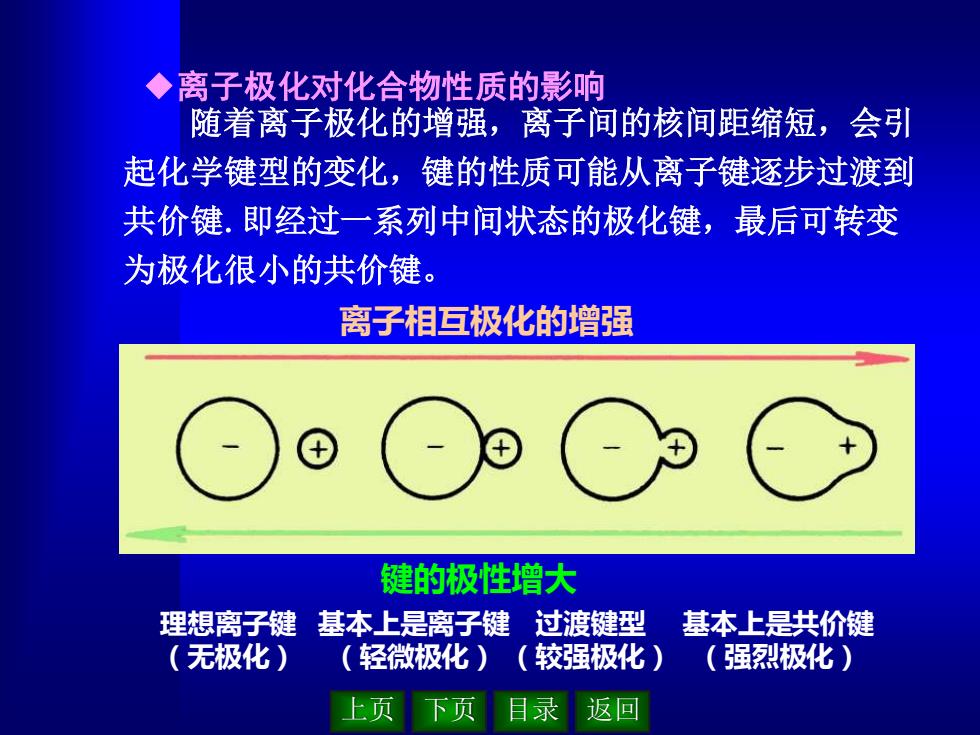
上页 下页 目录 返回 ◆离子极化对化合物性质的影响 随着离子极化的增强,离子间的核间距缩短,会引 起化学键型的变化,键的性质可能从离子键逐步过渡到 共价键.即经过一系列中间状态的极化键,最后可转变 为极化很小的共价键。 离子相互极化的增强 键的极性增大 理想离子键 (无极化) 基本上是离子键 (轻微极化) 过渡键型 (较强极化) 基本上是共价键 (强烈极化)
上页 下页 目录 返回 ◆离子极化对化合物性质的影响 随着离子极化的增强,离子间的核间距缩短,会引 起化学键型的变化,键的性质可能从离子键逐步过渡到 共价键.即经过一系列中间状态的极化键,最后可转变 为极化很小的共价键。 离子相互极化的增强 键的极性增大 理想离子键 (无极化) 基本上是离子键 (轻微极化) 过渡键型 (较强极化) 基本上是共价键 (强烈极化)