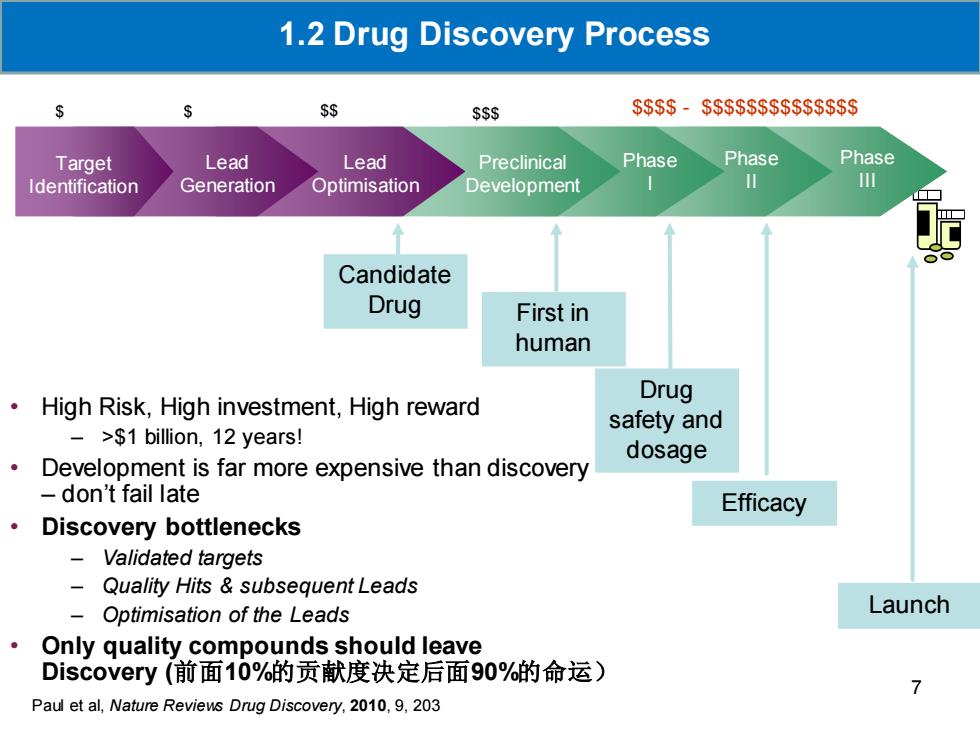
1.2 Drug Discovery Process $ SS $SS $$$-$$$$$$$$$ Target Lead Lead Preclinical Phase Phase Phase Identification Generation Optimisation Development 个 Candidate Drug First in human High Risk,High investment,High reward Drug safety and ->$1 billion,12 years! dosage Development is far more expensive than discovery don't fail late Efficacy 。 Discovery bottlenecks Validated targets Quality Hits subsequent Leads - Optimisation of the Leads Launch Only quality compounds should leave Discovery(前面10%的贡献度决定后面90%的命运) Paul et al,Nature Reviews Drug Discovery,2010,9,203
Candidate Drug First in human Drug safety and dosage Efficacy Launch Phase III Phase II Phase I Target Identification Lead Generation Lead Optimisation Preclinical Development $ $ $$ $$$ $$$$ - $$$$$$$$$$$$$$ Paul et al, Nature Reviews Drug Discovery, 2010, 9, 203 • High Risk, High investment, High reward – >$1 billion, 12 years! • Development is far more expensive than discovery – don’t fail late • Discovery bottlenecks – Validated targets – Quality Hits & subsequent Leads – Optimisation of the Leads • Only quality compounds should leave Discovery (前面10%的贡献度决定后面90%的命运) 1.2 Drug Discovery Process 7

Target-to-hit Hit-to-lead Lead optimization Preclinical PhaseI Phase ll Phase IⅢ Submission to launch Launch P(TS) 80% 75% 85% 69% 54% 34% 70% 91 WIP needed for 1 launch 24.3 19.4 14.6 12.4 8.6 4.6 1.6 11 Cost per WIP per Phase 525 10 $5 515 S40 S150 540 Cycle time(years) 1.0 15 2.0 1.0 15 25 25 15 Cost per launch (out of pocket)$24 549 5146 562 S128 5185 5235 544 5873 %Total cost per NME 3% 6% 17% 7% 15% 21% 27% 5% Cost of capita % Cost per launch(capitalized) 94 s166 5414 5150 5273 5319 S314 548 S178 ☐Discovery☐Development Figure 2|R&D model yielding costs to successfully discover and develop a single new molecular entity.The model defines the distinct phases of drug discovery and development from the initial stage of target-to-hit to the final stage,launch. The modelis based on aset of industry-appropriate RD assumptions(industry benchmarks and data from Eli Lilly and Compamy)defining the performance of the RoD process at each stage of development(see Supplementary information S2 (box)for details).RD parameters include:the probability of successful transition from one stage to the next(p(TS)),the phase cost for each project,the cycle time required to progress through each stage of development and the cost of capital, reflecting the returns required by shareholders to use their money during the lengthy R&D process.With these inputs(darker shaded boxes),the model calculates the number of assets(work in process,WIP)needed in each stage of development to achieve one new molecular entity(NME)launch.Based on the assumptions for success rate,cycle time and cost,the model further calculates the 'out of pocket'cost per phase as well as the total cost to achieve one NME launch per year(US$873 million).Lighter shaded boxes show calculated values based on assumed inputs.Capitalizing the cost,to account for the cost of capital during this period of over 13 years,yields a'capitalized'cost of S1,778 million per NME launch.It is important to note that this model does not include investments for exploratory discovery research,post-launch expenses or overheads (that is,salaries for employees not engaged in RoD activities but necessary to support the organization). 8 NATURE REVIEWS DRUG DISCOVERY VOLUME 9 MARCH 2010 203
8

1.2.1交通灯系统评估药物靶标 ● ● 靶标确认 没有或仅有较弱的证 遗传或化学证据表明靶 遗传和化学证据都表明靶标对 据表明靶标对细胞的 标对细胞的生长,存活 细胞的生长,存活,侵入或扩 生长,存活,侵入或 侵入或扩散有重要意义 散有重要意义 扩散有重要意义 检测技术 尚无非活体检测手段 已有非活体检测手段, 已有板模式的分析检测手段, (assay 或所需试剂有明显局 有开发为板模式的可行 并可在合理时间范围内提供足 feasibility) 限性 性 量的蛋白 可药性 新型的靶标体系,尚 靶标体系或抑制物已有 对靶标体系的机制有较为清晰 无已知的抑制剂或底 一定研究报道 的理解,小分子抑制剂的结构 物类似物 具有类似药物的物化特性或有 基因家族中的临床前导物。 毒性 已有宿主类似物,但 已有宿主类似物,有一 具有针对癌细胞的特异性,或 缺乏结构,化学或其 定的结构,化学或其它 已知的宿主类似物对人体健康 它证据表明选择性抑 证据表明选择性抑制的 并非必要 制的可能性 可能性 结构信息 尚无靶标蛋白的结构 不含配基的靶标蛋白结 高解析度的蛋白-配基复合体结 或相关的同族体 构已知,或结构解析度 构已知 较低(大于2.3埃),或 相关同族体和配基的结 构已知 Frearson et al.Trends in Parasitology 2007
靶标确认 没有或仅有较弱的证 据表明靶标对细胞的 生长,存活,侵入或 扩散有重要意义 遗传或化学证据表明靶 标对细胞的生长,存活, 侵入或扩散有重要意义 遗传和化学证据都表明靶标对 细胞的生长,存活,侵入或扩 散有重要意义 检测技术 (assay feasibility) 尚无非活体检测手段, 或所需试剂有明显局 限性 已有非活体检测手段, 有开发为板模式的可行 性 已有板模式的分析检测手段, 并可在合理时间范围内提供足 量的蛋白 可药性 新型的靶标体系,尚 无已知的抑制剂或底 物类似物 靶标体系或抑制物已有 一定研究报道 对靶标体系的机制有较为清晰 的理解,小分子抑制剂的结构 具有类似药物的物化特性或有 基因家族中的临床前导物。 毒性 已有宿主类似物,但 缺乏结构,化学或其 它证据表明选择性抑 制的可能性 已有宿主类似物,有一 定的结构,化学或其它 证据表明选择性抑制的 可能性 具有针对癌细胞的特异性,或 已知的宿主类似物对人体健康 并非必要 结构信息 尚无靶标蛋白的结构 或相关的同族体 不含配基的靶标蛋白结 构已知,或结构解析度 较低(大于2.3埃),或 相关同族体和配基的结 构已知 高解析度的蛋白-配基复合体结 构已知 Frearson et al. Trends in Parasitology 2007 ● ● ● 1.2.1 交通灯系统评估药物靶标 9

首创药物和模拟创新药物 Pioneering drug Follow-on drug(me-too me better) 目标 First in class Best in class 靶标 全新 已知 药物结构 未知 已知 化学空间 大 局限 市场 暂无竞争,投入大,风险大 竞净激烈,投入较小,风险较小 驱动力 生物 化学 模拟创新必要性: 1.首创药物有巨大的优化空间 2.路径清晰,成功率高 人 Sidenafil (Viagra) 3.克服耐药性 Vardenafil 4.P 靶标:PDE5 (phosphodiesterase type 5) Udenafil 10
首创药物和模拟创新药物 Pioneering drug Follow-on drug (me-too / me better) 目标 First in class Best in class 靶标 全新 已知 药物结构 未知 已知 化学空间 大 局限 市场 暂无竞争,投入大,风险大 竞争激烈,投入较小,风险较小 驱动力 生物 化学 模拟创新必要性: 1. 首创药物有巨大的优化空间 2. 路径清晰,成功率高 3. 克服耐药性 4. IP N HN N N CH3 CH3 O O CH3 S O O N N H3C Sidenafil (Viagra) N N H3C S O O O CH3 N HN N N O CH3 H3C Vardenafil N NH S N N H N N CH3 CH3 O CH3 CH3 O O O Udenafil 靶标:PDE5 (phosphodiesterase type 5) 10
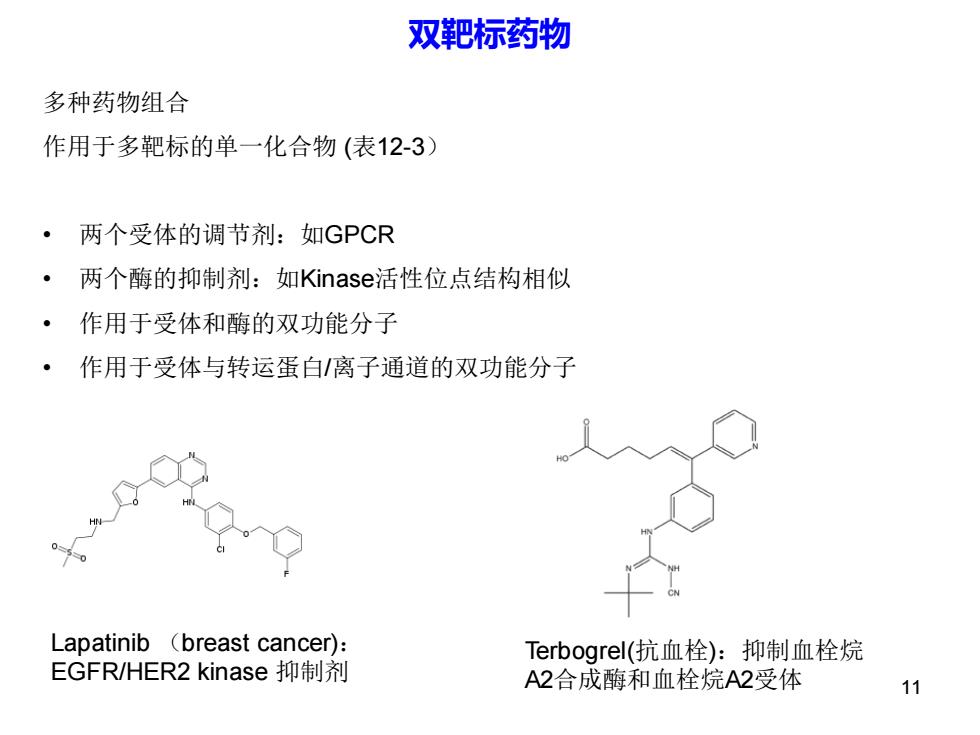
双靶标药物 多种药物组合 作用于多靶标的单一化合物(表12-3) 两个受体的调节剂:如GPCR 两个酶的抑制剂:如Kinase活性位点结构相似 作用于受体和酶的双功能分子 作用于受体与转运蛋白/离子通道的双功能分子 Lapatinib (breast cancer): Terbogrel(抗血栓):抑制血栓烷 EGFR/HER2 kinase抑制剂 A2合成酶和血栓烷A2受体 11
双靶标药物 多种药物组合 作用于多靶标的单一化合物 (表12-3) • 两个受体的调节剂:如GPCR • 两个酶的抑制剂:如Kinase活性位点结构相似 • 作用于受体和酶的双功能分子 • 作用于受体与转运蛋白/离子通道的双功能分子 Lapatinib (breast cancer): EGFR/HER2 kinase 抑制剂 Terbogrel(抗血栓):抑制血栓烷 A2合成酶和血栓烷A2受体 11