
第六章酸碱平衡 § 1.1 酸碱理论 §1.2 水的质子自递平斯 §1.3 弱酸弱碱电离平斯 §1.4 缓冲溶液
第六章 酸碱平衡 § 1.1 酸碱理论 § 1.2 水的质子自递平衡 § 1.3 弱酸弱碱电离平衡 § 1.4 缓冲溶液

§6.1 酸碱理论 大量的化学变化都属于酸碱反应,掌握酸碱反 应的本质和规律,研究酸碱理论,是化学研究的重 要内容。 人们很早就发现并使用了酸和碱,硫酸、盐酸、 硝酸等强酸是炼金术家在公元1100-1600年间发现 的,但当时人们并不知道酸碱的组成。 物质表 酸:酸味使蓝色石蕊变红 现出来 的性质 碱:涩味使红色石蕊变蓝
大量的化学变化都属于酸碱反应,掌握酸碱反 应的本质和规律,研究酸碱理论,是化学研究的重 要内容。 人们很早就发现并使用了酸和碱,硫酸、盐酸、 硝酸等强酸是炼金术家在公元1100-1600年间发现 的,但当时人们并不知道酸碱的组成。 §6.1 酸碱理论 物质表 现出来 的性质 酸: 酸味 使蓝色石蕊变红 碱: 涩味 使红色石蕊变蓝

1887年瑞典科学家阿仑尼乌斯提出的酸碱电离理论: 凡是在水溶液中能够电离产生H的物质为酸; 能电离产生OH的物质为碱。 从物质的化学组成上揭示了酸碱的本质,H十是 酸的特征;OH是碱的特征。中和反应的实质为: H++OH- H2O 化合生成水 局限性:1、无法解释不含OH的物质也显碱性的问题。 2、无法解释物质在非水溶剂(如乙醇、苯、液氨)中 的酸碱性问题
1887年瑞典科学家阿仑尼乌斯提出的酸碱电离理论: 凡是在水溶液中能够电离产生H+的物质为酸; 能电离产生OH-的物质为碱。 局限性: 1、无法解释不含OH-的物质也显碱性的问题。 从物质的化学组成上揭示了酸碱的本质,H+是 酸的特征;OH-是碱的特征。中和反应的实质为: H++OH- H2O 化合生成水 2、无法解释物质在非水溶剂(如乙醇、苯、液氨)中 的酸碱性问题

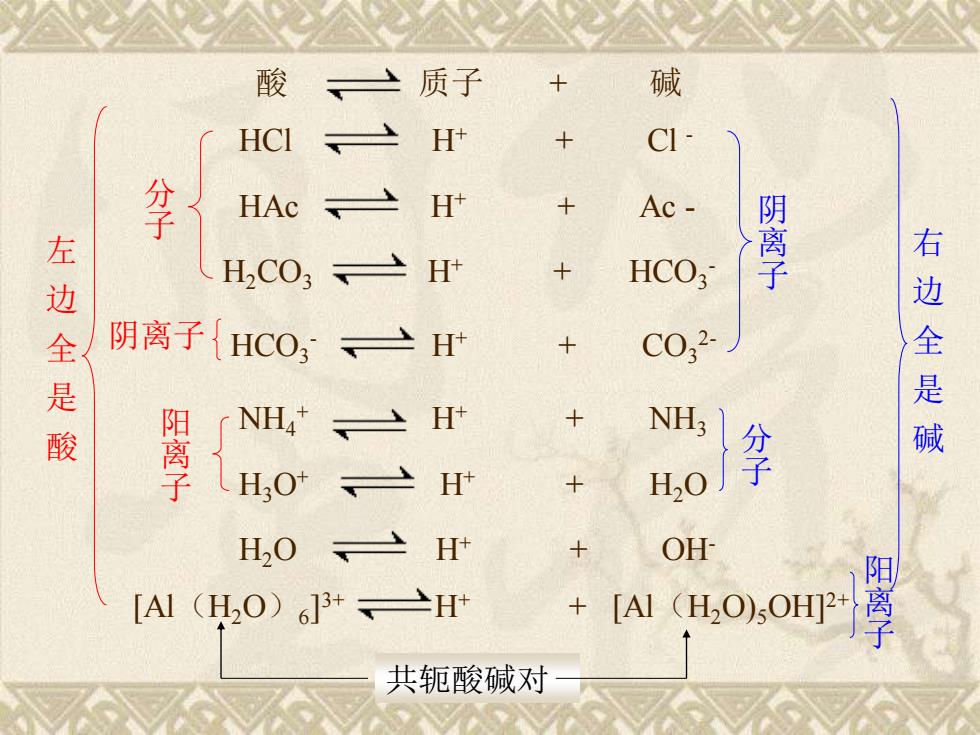
一、 酸碱质子理论(proton theory of acid and base) (一)定义(1923年丹麦布朗斯台德和英国洛里) 凡是给出质子的物质都是酸(acid); 酸碱质子理论 如HCI、HAc、NH4、HO等 凡是接受质子的物质都是碱(baSe) 如CIAc-、NH3、OH等 酸碱之间的共轭关系:酸和碱不是孤立的,酸给 出质子余下的部分就是碱,碱接受质子后又变为酸。 “有酸才有碱,有碱才有酸,酸中有碱,碱可变酸
一、酸碱质子理论(proton theory of acid and base) (一)定义(1923年丹麦 布朗斯台德和英国 洛里) 凡是给出质子的物质都是酸(acid); 如HCl 、 HAc、 NH4 + 、 H2O 等 凡是接受质子的物质都是碱(base) 如Cl -、Ac -、 NH3、 OH- 等 酸碱之间的共轭关系:酸和碱不是孤立的,酸给 出质子余下的部分就是碱,碱接受质子后又变为酸。 “有酸才有碱,有碱才有酸,酸中有碱,碱可变酸” 。 酸碱质子理论
酸 质子 碱 HCI 竿 HAc 11111 H + CI H + Ac- + 阴离子 左边全是酸 H2C03 HCO: 阴离子{HCO C032 NH H NH3 右边全是碱 阳离子 H.O H H20 分子 H20 H OH 阳 [A1(H0)6]3+→H +[A1(H20)5OH2 离子 共轭酸碱对
[Al(H2O)6 ] 3+ H+ + [Al(H2O)5OH]2+ 酸 质子 + 碱 HCl H+ + Cl - HAc H+ + Ac - H2CO3 H+ + HCO3 - HCO3 - H+ + CO3 2- NH4 + H+ + NH3 H3O+ H+ + H2O H2O H+ + OH- 分 子 阳 离 子 阴离子 左 边 全 是 酸 阴 离 子 分 子 阳 离 子 右 边 全 是 碱 共轭酸碱对