
第三章化学反应速率 §3.1 化学反应速率和反应机理 §3.2 反应速率理论简介 §3.3影响反应速率的因素
第三章 化学反应速率 § 3.1 化学反应速率和反应机理 § 3.2 反应速率理论简介 § 3.3 影响反应速率的因素

§3.1化学反应速率和反应机理 一、化学反应速率的表示方法 化学反应速率一定条件下单位时间内某化学反应的反 应物转变为生成物的速率。 对于均匀体系的恒容反应,习惯用单位时间内反应物浓 度的减少或生成物浓度的增加来表示,而且习惯取正值。浓 度单位通常用moL,时间单位视反应快慢,可分别用秒 (s)、分(in)或小时(h)等表示。这样,化学反应速率的单位 可为moLl.sl、mol.L-1.min-l、molL-1.h-l
§3.1 化学反应速率和反应机理 一、化学反应速率的表示方法 化学反应速率 一定条件下单位时间内某化学反应的反 应物转变为生成物的速率。 对于均匀体系的恒容反应,习惯用单位时间内反应物浓 度的减少或生成物浓度的增加来表示,而且习惯取正值。浓 度单位通常用mol·L-1,时间单位视反应快慢,可分别用秒 (s)、分(min)或小时(h)等表示。这样,化学反应速率的单位 可为mol·L-1·s-1 、mol·L-1·min-1 、mol·L-1·h-1

二、化学反应的平均速率 室温时含有少量的情况下,过氧化氢水溶液的分解反 应为: H,0,(ag)IH0D+120,(g 由实验测定氧的量,便可计算出H,O,浓度的变化。若 有一份浓度为0.80ol/L的H,O,溶液,分解过程中的浓度 变化如表3-1 反应速率)=- c(HO2)2-c(H2O2)1_△c(H2O2) t2-ti △t
二、化学反应的平均速率 室温时含有少量I –的情况下,过氧化氢水溶液的分解反 应为: H2O2(aq)== H2O(l)+1/2O2(g) I - 由实验测定氧的量,便可计算出 H2O2 浓度的变化。若 有一份浓度为 0.80mol/L 的H2O2溶液,分解过程中的浓度 变化如表3-1 t c H O t t c H O c H O − − = − ( ) − ( ) ( ) 2 2 2 1 1 2 2 2 反应速率 2 2 =
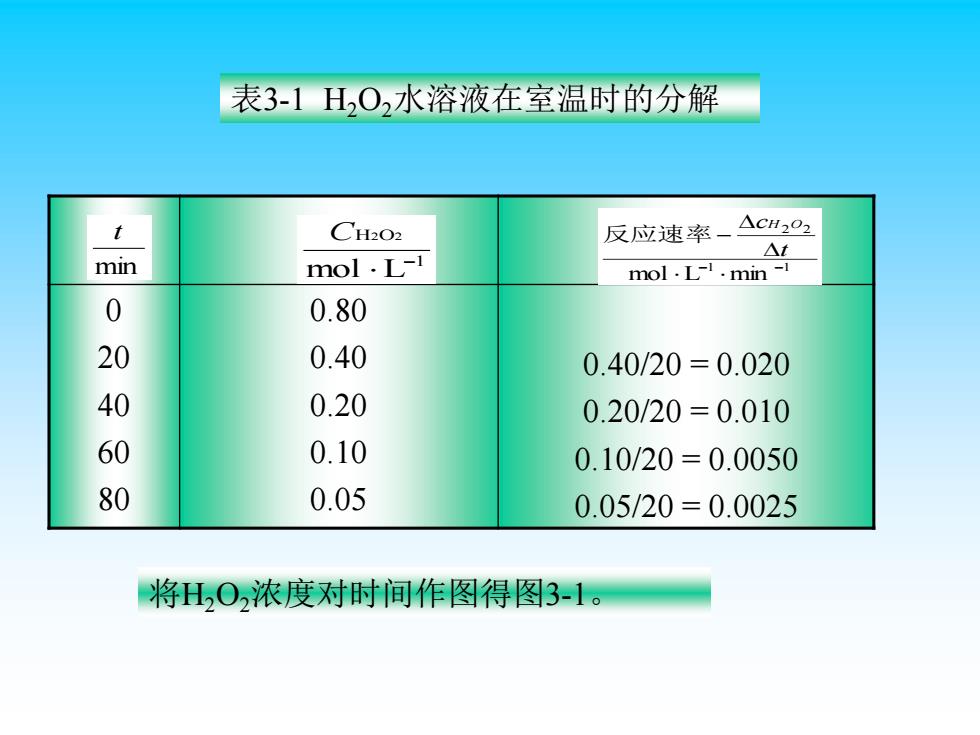
表3-1HO2水溶液在室温时的分解 t CH202 反应速率一 △CH202 mol.L-1 △t min mol.L min-1 0 0.80 20 0.40 0.40/20=0.020 40 0.20 0.20/20=0.010 60 0.10 0.10/20=0.0050 80 0.05 0.05/20=0.0025 将HO,浓度对时间作图得图3-1
表3-1 H2O2水溶液在室温时的分解 0 20 40 60 80 0.80 0.40 0.20 0.10 0.05 0.40/20 = 0.020 0.20/20 = 0.010 0.10/20 = 0.0050 0.05/20 = 0.0025 将H2O2浓度对时间作图得图3-1。 1 1 2 2 mol L min − − − t cH O 反应速率 1 H O mol L 2 2 − C min t
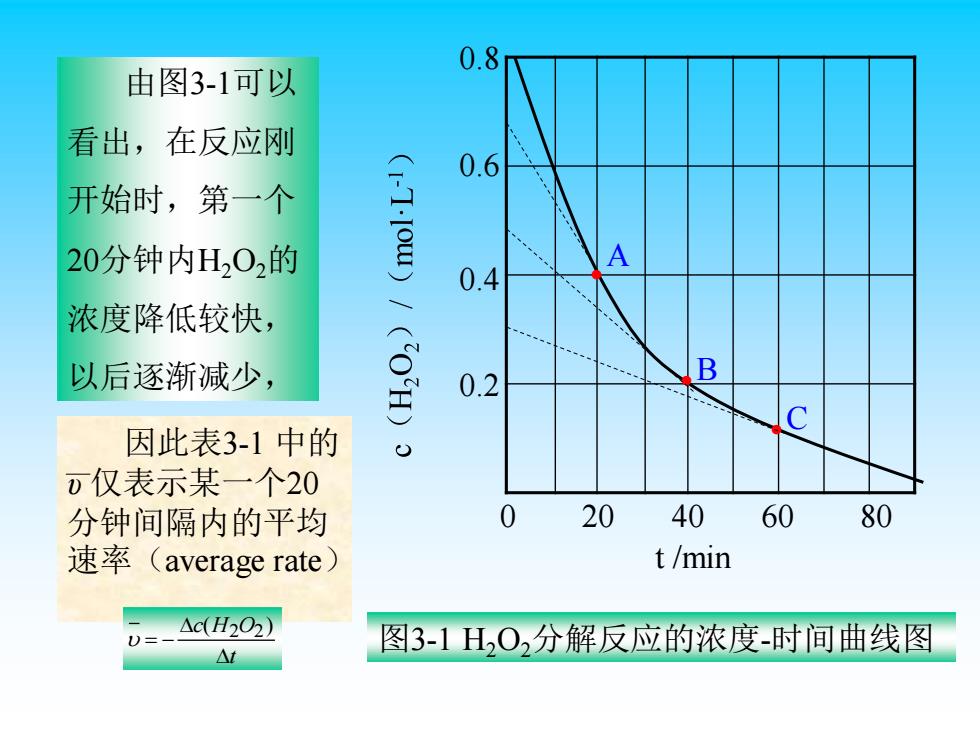
0.8 由图3-1可以 看出,在反应刚 0.6 开始时,第一个 20分钟内H202的 A 0.4 浓度降低较快, 以后逐渐减少, 0.2 B 因此表3-1中的 0仅表示某一个20 分钟间隔内的平均 20 40 60 80 速率(average rate) t/min △c(H2O2) 图3-1HO,分解反应的浓度-时间曲线图 △t
• • • C B A 0 20 40 60 80 0.2 0.4 0.6 0.8 t /min 图3-1 H2O2分解反应的浓度-时间曲线图 由图3-1可以 看出,在反应刚 开始时,第一个 20分钟内H2O2的 浓度降低较快, 以后逐渐减少, 因此表3-1 中的 υ 仅表示某一个20 分钟间隔内的平均 速率(average rate) t c H O = − ( ) 2 2