
缓中溶液 在工农业生产、科研工作和许多天然体系中,都需要溶 液的H保持一定范围内,才能使反应和活动正常进行。 溶液的PH如何控制?怎样使溶液的H保持稳定? 缓冲溶液组成及作用机理 1.概念: 请大家看实验:
一、 缓冲溶液组成及作用机理 1.概念: 请大家看实验: 缓冲溶液 在工农业生产、科研工作和许多天然体系中,都需要溶 液的pH保持一定范围内,才能使反应和活动正常进行。 溶液的PH如何控制?怎样使溶液的pH保持稳定?
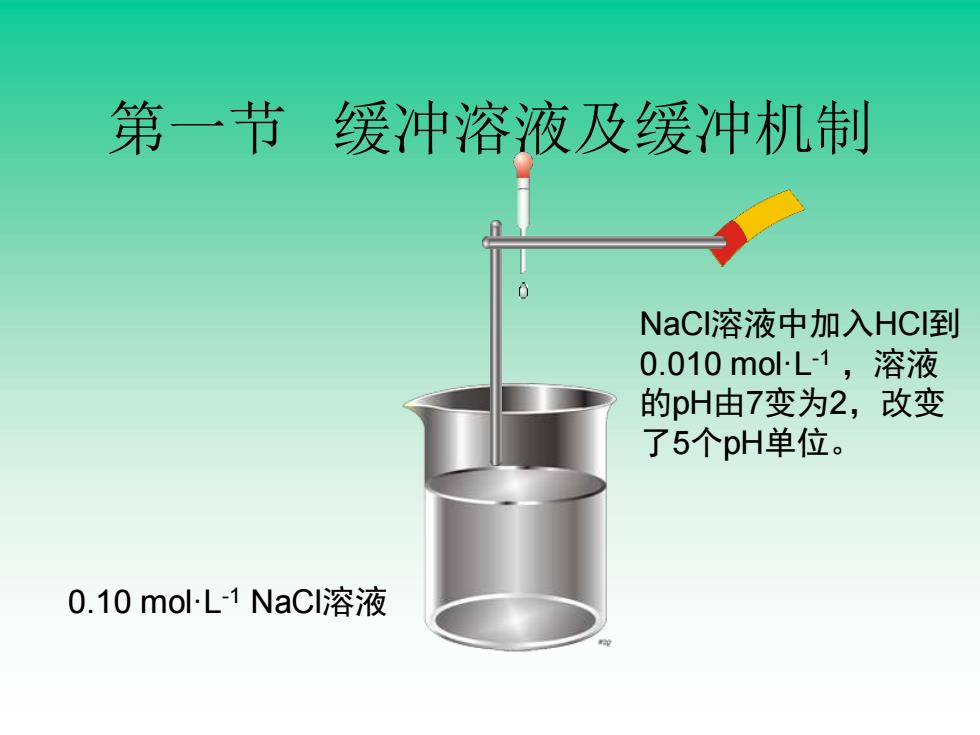
第一节缓冲溶液及缓冲机制 NaC溶液中加入HC到 0.010molL1,溶液 的pH由7变为2,改变 了5个pH单位。 0.10molL-1NaCl溶液
第一节 缓冲溶液及缓冲机制 0.10 mol·L-1 NaCl溶液 NaCl溶液中加入HCl到 0.010 mol·L-1 ,溶液 的pH由7变为2,改变 了5个pH单位

第一节缓冲溶液及缓冲机制 0.10 mol-L-1 HAc- 0.10molL-1NaAc溶液 溶液中加入HC到 0.010moL1,溶液 的pH由4.75变为4.74, 改变仅0.01pH单位。 0.10 mol.L-1 HAc- 0.10molL1NaAc溶液
第一节 缓冲溶液及缓冲机制 0.10 mol·L-1 HAc — 0.10 mol·L -1 NaAc溶液 0.10 mol·L-1 HAc — 0.10 mol·L-1 NaAc溶液 溶液中加入HCl到 0.010 mol·L-1 ,溶液 的pH由4.75变为4.74, 改变仅0.01pH单位
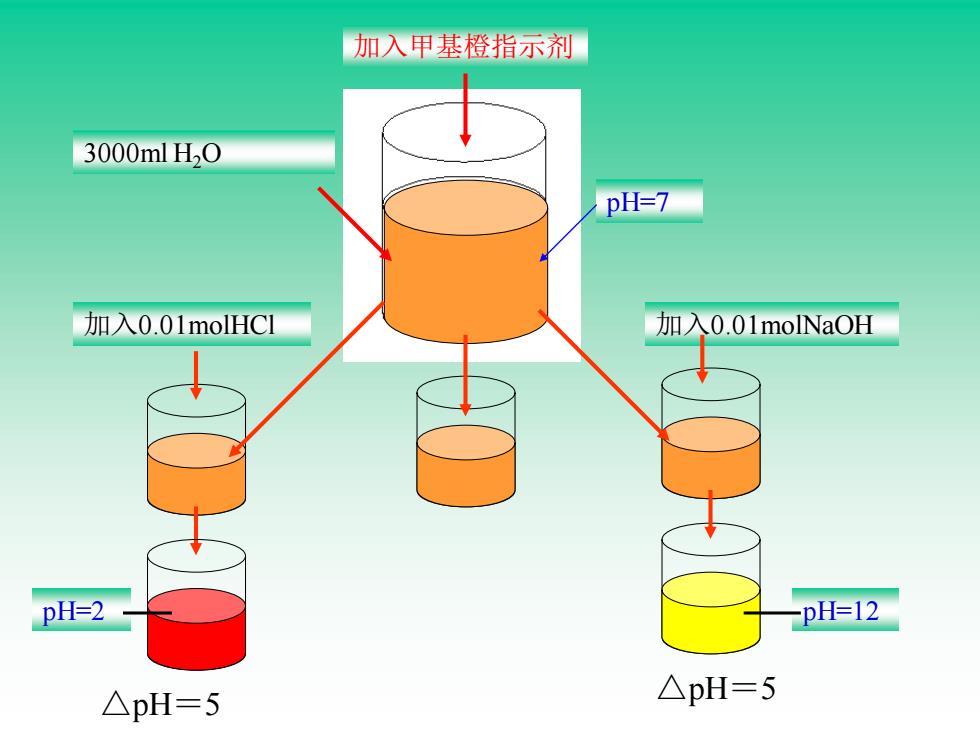
加入甲基橙指示剂 3000mlH0 pH=7 加入0.01 molHC1 加入0.01 molNaOH pH=2 -pH=12 △pH=5 △pH=5
加入甲基橙指示剂 3000ml H2O pH=7 加入0.01molHCl pH=2 加入0.01molNaOH pH=12 △pH=5 △pH=5
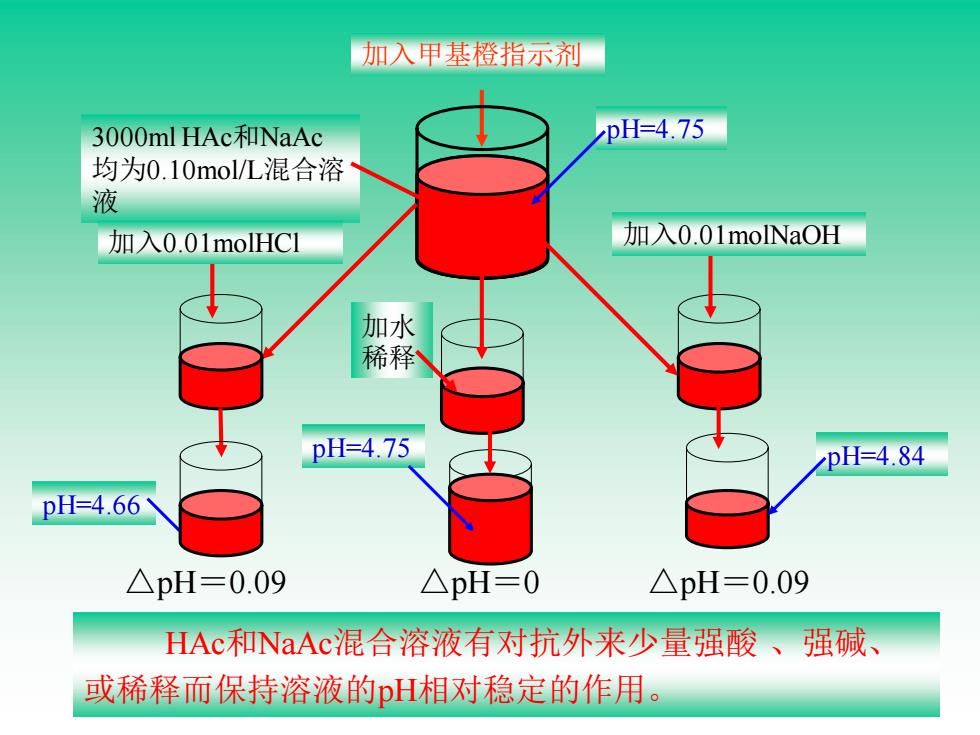
加入甲基橙指示剂 3000 ml HAc和NaAc pH=4.75 均为0.10mol/L混合溶 液 加入0.01 molHC1 加入0.01 molNaOH 加水 稀释 pH=4.75 pH=4.84 pH=4.66 △pH=0.09 △pH=0 △pH=0.09 HAc和NaAc混合溶液有对抗外来少量强酸、强碱、 或稀释而保持溶液的pH相对稳定的作用
加入甲基橙指示剂 3000ml HAc和NaAc 均为0.10mol/L混合溶 液 pH=4.75 加入0.01molHCl pH=4.66 加水 稀释 pH=4.75 加入0.01molNaOH pH=4.84 HAc和NaAc混合溶液有对抗外来少量强酸 、强碱、 或稀释而保持溶液的pH相对稳定的作用。 △pH=0.09 △pH=0 △pH=0.09