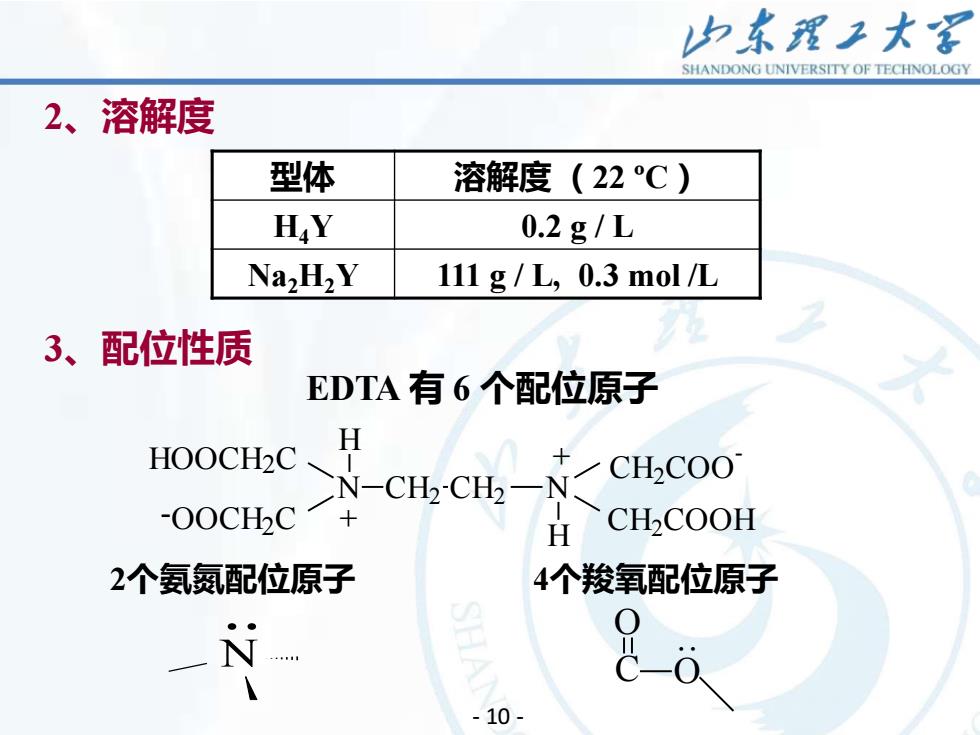
力东理王大 SHANDONG UNIVERSITY OF TECHNOLOGY 2、溶解度 型体 溶解度(22℃) H.Y 0.2g/L Na2H2Y 111g/L,0.3mol/L 3、配位性质 EDTA有6个配位原子 HOOCH2C、 H CH2COO N-CHCH一N -O0CHC H CH-COOH 2个氨氮配位原子 4个羧氧配位原子 N -10-
11 2、溶解度 型体 溶解度 (22 ºC) H4Y 0.2 g / L Na2H2Y 111 g / L, 0.3 mol /L 3、配位性质 EDTA 有 6 个配位原子 HOOCH2C N H CH2 COO - CH2 COOH N H CH2 CH2 -OOCH2 C + + 2个氨氮配位原子 N . 4个羧氧配位原子 O C O . - 10 -
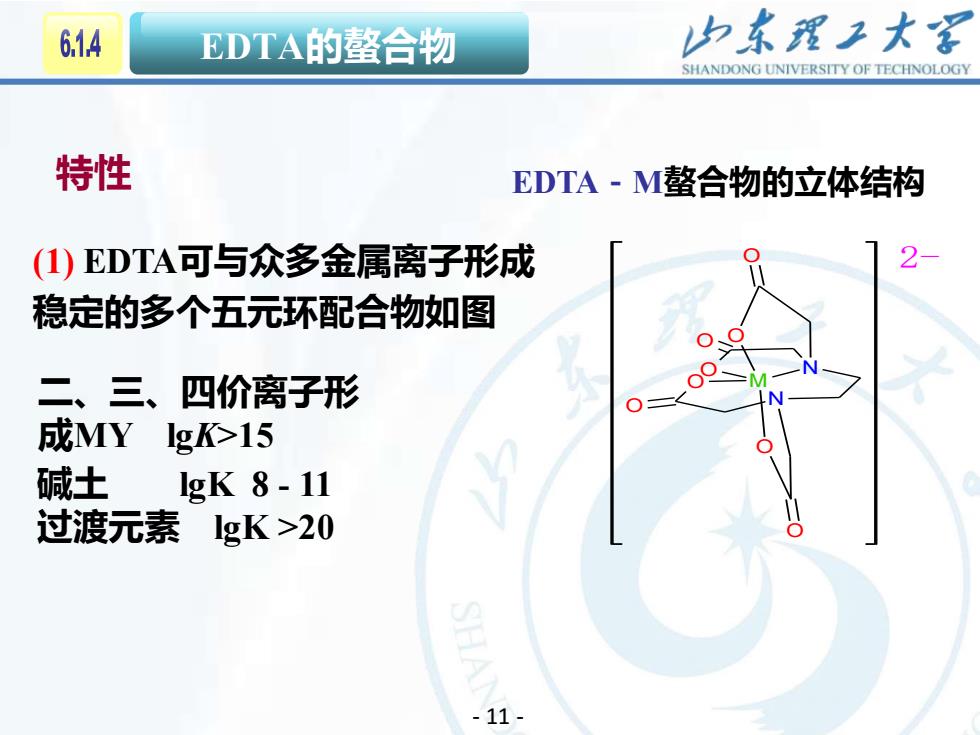
614 EDTA的螯合物 归东理工大军 SHANDONG UNIVERSITY OF TECHNOLOGY 特性 EDTA-M螯合物的立体结构 (1)EDTA可与众多金属离子形成 稳定的多个五元环配合物如图 二、三、四价离子形 O 成MY Igk>15 碱土 gK8-11 过渡元素 gK>20 -11-
12 EDTA的螯合物 EDTA-M螯合物的立体结构 N M N O O O O O O O (1) EDTA可与众多金属离子形成 O 2- 稳定的多个五元环配合物如图 二、三、四价离子形 成MY lgK>15 碱土 lgK 8 - 11 过渡元素 lgK >20 特性 - 11 -

力东理王大 SHANDONG UNIVERSITY OF TECHNOLOGY (2)配合比固定而简单,多数为1:1型,少数为2:1型 如:Mo(V) 计量数关系为1:1,通式(略电荷): M+Y-MY (3)配合物带电荷且易溶于水 (4)反应快,滴定终点易判断 (⑤)EDTA与无色的金属离子形成无色的络合物;金属离子带色, 形成MY也带色且颜色加深,可定性分析 CuY NiY CoY MnY (深蓝) (蓝绿) (玫瑰) (紫红) CrY Cr(OH)Y2- FeY Fe(OH)Y2- (深紫) (蓝) 黄) (褐) -12-
13 (5) EDTA与无色的金属离子形成无色的络合物;金属离子带色, 形成MY也带色且颜色加深,可定性分析 CuY NiY CoY MnY (深蓝) (蓝绿) (玫瑰) (紫红) CrY Cr(OH)Y2- FeY Fe(OH)Y2- (深紫) (蓝) (黄) (褐) (3) 配合物带电荷且易溶于水 (4) 反应快,滴定终点易判断 (2) 配合比固定而简单,多数为1:1型,少数为2:1型 (如:Mo(Ⅴ)) 计量数关系为1:1,通式(略电荷): M+Y=MY - 12 -

6.2 络合物的平衡常数 稳定常数 归东理工大得 SHANDONG UNIVERSITY OF TECHNOLOGY 621 络合物的稳定常数 一、螯合物(1:1型络合物) Ca2++Y4± CaY2- [CaY2-] [Ca2+][Y4] M+Y→MY [MY] [M·[Y] -13-
14 络合物的平衡常数——稳定常数 络合物的稳定常数 [Ca ] [ ] [C Y ] 2 4 2 + − − = Y a Ca K稳 2+ + Y 4- CaY 2- 一、螯合物(1:1型络合物) M + Y MY [M] [Y] [MY] KMY = - 13 -

二、 1:n型络合物(简单络合物) 力东理王大 SHANDONG UNIVERSITY OF TECHNOLOGY 1、 逐级稳定常数K稳 金属离子M能与配位剂L逐步形成ML,型配合物,每一 步都有配位平衡和相应的稳定常数(逐级稳定常数K稳) [ML M+L→ML K稳1= [MIIL] ML+L台ML2 K稳2 [ML2] [ML]IL] MLn1+L台ML. K稳n= [ML,] [ML-IL] -14-
15 二、 1:n型络合物(简单络合物) 金属离子M能与配位剂L逐步形成MLn型配合物,每一 步都有配位平衡和相应的稳定常数(逐级稳定常数K稳n ) M+ L ML [ ][ ] [ ] 1 M L ML K稳 = ML + L ML2 [ ][ ] [ ] 2 2 ML L ML K稳 = MLn−1 + L MLn [ ][ ] [ ] ML 1 L ML K n n n − 稳 = 1、逐级稳定常数K稳 ● ● ● ● ● ● - 14 -