
在下图中,自由能是作为反应进程的函数来表示的,△G相当 于反应热,△G为正反应的活化自由能,而△G为逆反应的活 化自由能.应当指出,过渡态相当于反应进程中能量的最高点, 不能看成中间体.任何中间体即使是最不稳定的,也都对应于 相对的最低能态,为了从中间体过渡到最终状态,尚需克服一 个能垒(即第二过渡状态)
在下图中,自由能是作为反应进程的函数来表示的,ΔG相当 于反应热, 为正反应的活化自由能,而 为逆反应的活 化自由能.应当指出,过渡态相当于反应进程中能量的最高点, 不能看成中间体.任何中间体即使是最不稳定的,也都对应于 相对的最低能态,为了从中间体过渡到最终状态,尚需克服一 个能垒(即第二过渡状态). Gf Gr

B--C G A+BC AG AB+C 反应坐标 总 反应坐标
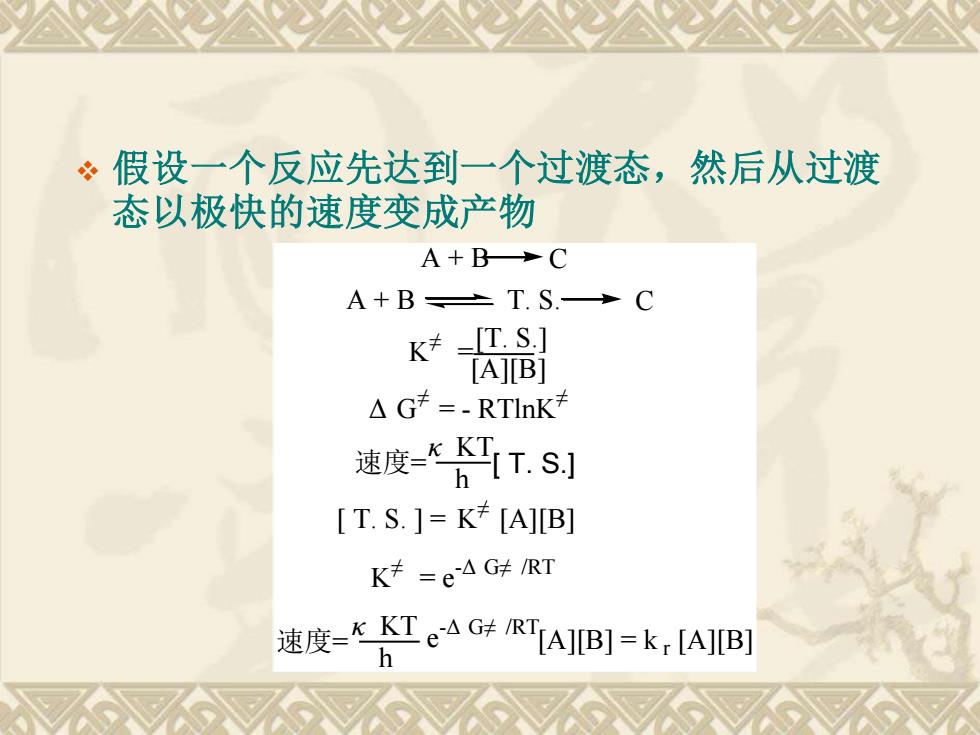
·假设一个反应先达到一个过渡态,然后从过渡 态以极快的速度变成产物 A+BC A+BT.S.→C K≠=TS] [A]B] △G≠=.RTlnK 速度=KK工 T.S.J [T.S.]=K[A]B] K≠=e△GtRT 速度=KTeAG¥RTLA]B]=kr[A]B
❖ 假设一个反应先达到一个过渡态,然后从过渡 态以极快的速度变成产物 [ T. S.] [A][B] C C [A][B] = k r [A][B] A + B A + B T. S. K ≠ = [T. S.] Δ G ≠ = - RTlnK ≠ 速度= κ KT h [ T. S. ] = K ≠ [A][B] K ≠ = e -Δ G≠ /RT 速度= κ KT h e -Δ G≠ /RT

在兰步反应的图中能量最高点是活化络 合物(图a.),在它的左边,所有络合物都 被认为同反应物处于平衡中;而在它右 边,所有络合物则被认为是同产物处于 平衡中。 G G 过渡态 △G1 △G, 中间体 A+B A+B 反应物 反应物 △G 产物 0 产物 a单步反应 b双步反应
❖ 在一步反应的图中能量最高点是活化络 合物(图a.),在它的左边,所有络合物都 被认为同反应物处于平衡中;而在它右 边,所有络合物则被认为是同产物处于 平衡中。 A+B 反应物 D 产物 △ G 双步 反 应 G Δ G1 ≠ Δ G2 ≠ C 中间体 A+B 反应物 C 产物 过渡态 △ G 单 步 反 应 G Δ G1 ≠ a b

在双步反应的图b中 反应物和产物之间包括具有一定寿命的中间体, 因此,它包含有两个过渡态,而且第一个过渡态 的△G比第二个过渡态的△G,高,这意味着第 一步反应应该是速率控制步骤。 女 过渡态与中间体的区别。中间体位于两个过渡 态之间的能量最低点,故有一定的存活期,实 际的寿命依赖于凹陷的深度。下凹浅暗示下一 步的活化能低,生存期短,下凹深中间体的生 存期越长;而过渡态只有一个转瞬即逝的生存 期,并代表反应途径中的能量极大值
在双步反应的图b中 ❖ 反应物和产物之间包括具有一定寿命的中间体I, 因此,它包含有两个过渡态,而且第一个过渡态 的ΔG1 ≠比第二个过渡态的ΔG2 ≠高,这意味着第 一步反应应该是速率控制步骤。 ❖ 过渡态与中间体的区别。中间体位于两个过渡 态之间的能量最低点,故有一定的存活期,实 际的寿命依赖于凹陷的深度。下凹浅暗示下一 步的活化能低,生存期短,下凹深中间体的生 存期越长;而过渡态只有一个转瞬即逝的生存 期,并代表反应途径中的能量极大值