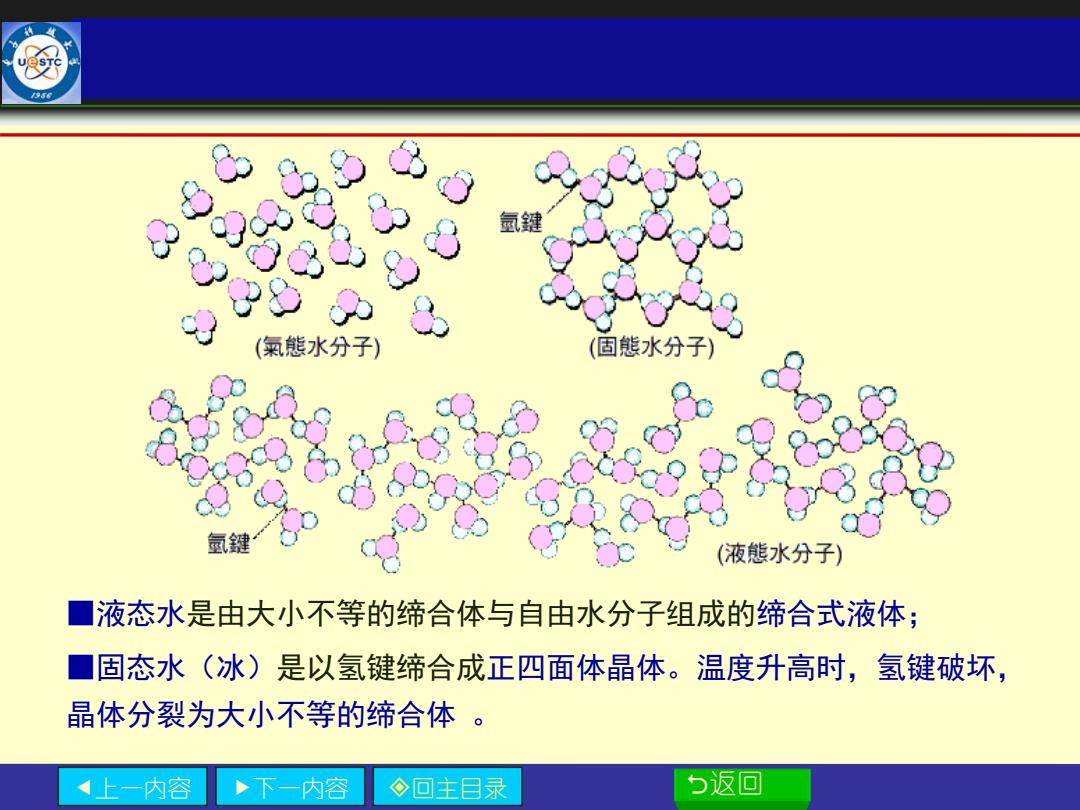
氫鍵 (氣態水分子) (固態水分子) 氫鍵 液態水分子) ■ 液态水是由大小不等的缔合体与自由水分子组成的缔合式液体; ]固态水(冰)是以氢键缔合成正四面体晶体。温度升高时,氢键破坏, 晶体分裂为大小不等的缔合体。 上一内容 ·下一内容 ◇回主目录 5返回
上一内容 下一内容 回主目录 返回 ■液态水是由大小不等的缔合体与自由水分子组成的缔合式液体; ■固态水(冰)是以氢键缔合成正四面体晶体。温度升高时,氢键破坏, 晶体分裂为大小不等的缔合体

●电解质溶于水时,同时存在两种作用: ·电离作用:中性原子或分子形成能自由移动的离子的过程。 水化作用:物质与水发生化合叫水化作用,又称水合作用。 离子不能裸露存在,离子与水分子相互作用导致水分子定向 排列,这样的结果破坏了水层的四面体结构。 ● 离子水化产生两种影响: 溶剂对溶质的影响:离子水化减少溶液中自由离子(未水化离 子)的数量,同时增加离子的体积; 溶质对溶剂的影响:带电离子的水化破坏附近水层的四面体 结构,改变邻近水分子层的介电常数。 上一内容 ·下一内容 ◇回主目录 5返回
上一内容 下一内容 回主目录 返回 ●电解质溶于水时,同时存在两种作用: • 电离作用:中性原子或分子形成能自由移动的离子的过程。 • 水化作用:物质与水发生化合叫水化作用,又称水合作用。 离子不能裸露存在,离子与水分子相互作用导致水分子定向 排列,这样的结果破坏了水层的四面体结构。 ●离子水化产生两种影响: • 溶剂对溶质的影响:离子水化减少溶液中自由离子(未水化离 子)的数量,同时增加离子的体积; • 溶质对溶剂的影响:带电离子的水化破坏附近水层的四面体 结构,改变邻近水分子层的介电常数

离子水化作用对其导电能力的影响 离子的极限摩尔电导率与其淌度成正比 。=z*F。 (1) 几。=zFo ze,E 根据斯托克斯方程,Vax 6π7 溶剂化离子半径 及离子淌度定义: 1u三 E zeo 极限离子淌度: (2) 6πnr 知:离子淌度与离子半径成反比。 上一内容 下一内容 ◇回主目录 5返回
上一内容 下一内容 回主目录 返回 • 离子的极限摩尔电导率与其淌度成正比 根据斯托克斯方程, 及离子淌度定义: 知:离子淌度与离子半径成反比。 o o o o z Fu z Fu + + + − − − = = max 1 6 o ze E v r = max v u E = 0 1 6 o ze u r = 溶剂化离子半径 离子水化作用对其导电能力的影响 极限离子淌度: (1) (2)
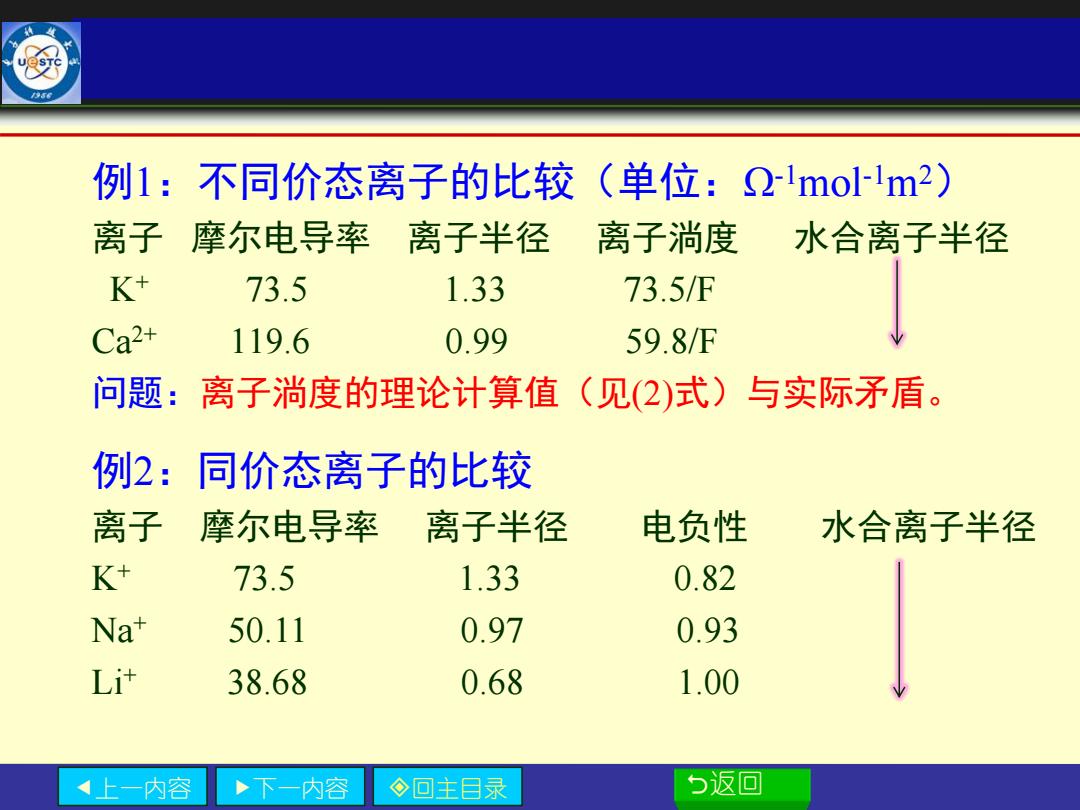
例1:不同价态离子的比较(单位:-mol-Im2) 离子摩尔电导率 离子半径 离子淌度 水合离子半径 K+ 73.5 1.33 73.5/F Ca2+ 119.6 0.99 59.8/F 问题:离子淌度的理论计算值(见(2)式)与实际矛盾。 例2:同价态离子的比较 离子 摩尔电导率 离子半径 电负性 水合离子半径 K+ 73.5 1.33 0.82 Na+ 50.11 0.97 0.93 L进 38.68 0.68 1.00 上一内容 下一内容 ◇回主目录 5返回
上一内容 下一内容 回主目录 返回 例1:不同价态离子的比较(单位:Ω-1mol-1m2) 离子 摩尔电导率 离子半径 离子淌度 水合离子半径 K+ 73.5 1.33 73.5/F Ca2+ 119.6 0.99 59.8/F 问题:离子淌度的理论计算值(见(2)式)与实际矛盾。 例2:同价态离子的比较 离子 摩尔电导率 离子半径 电负性 水合离子半径 K+ 73.5 1.33 0.82 Na+ 50.11 0.97 0.93 Li+ 38.68 0.68 1.00

离子水合程度用Hittorf法测定: 在含有蔗糖水溶液的Hittorf管中加入电解质(如LiCI),用 糖度计、糖度折射仪、旋光法等测定各区糖的浓度变化。 在电场中,水合离子定向迁移,使各区糖度不同,即阳极 区糖度增加,阴极区减小,中间区不变。为什么? ·主要阳离子的水合分子数: Mg2+:10-12; K+:5.4;Na:8.4; L计:14 注:阴离子水合能力较弱,特别是有机阴离子半径大,其导电率非常小。 上 内容 下一内容 ◇回主目录 5返回
上一内容 下一内容 回主目录 返回 • 离子水合程度用Hittorf法测定: • 在含有蔗糖水溶液的Hittorf管中加入电解质(如LiCl),用 糖度计、糖度折射仪、旋光法等测定各区糖的浓度变化。 • 在电场中,水合离子定向迁移,使各区糖度不同,即阳极 区糖度增加,阴极区减小,中间区不变。为什么? • 主要阳离子的水合分子数: • Mg2+:10-12; K+:5.4; Na+:8.4; Li+:14 • 注:阴离子水合能力较弱,特别是有机阴离子半径大,其导电率非常小