
若生成Ag2CrO4↓: [Ag P[CrO2-]-Ksp. 得:[Cr042]=3.0×10-3M 50mL中:3.0×10-3×50=0.14mmol. 需要5%铬酸钾体积: 5V 冠 =0.14×10-3 100M 计算V=0.82ml
▪ 若生成Ag2CrO4↓: 5 3 0.14 10 100 V M − = 需要5%铬酸钾体积: 计算V=0.82ml
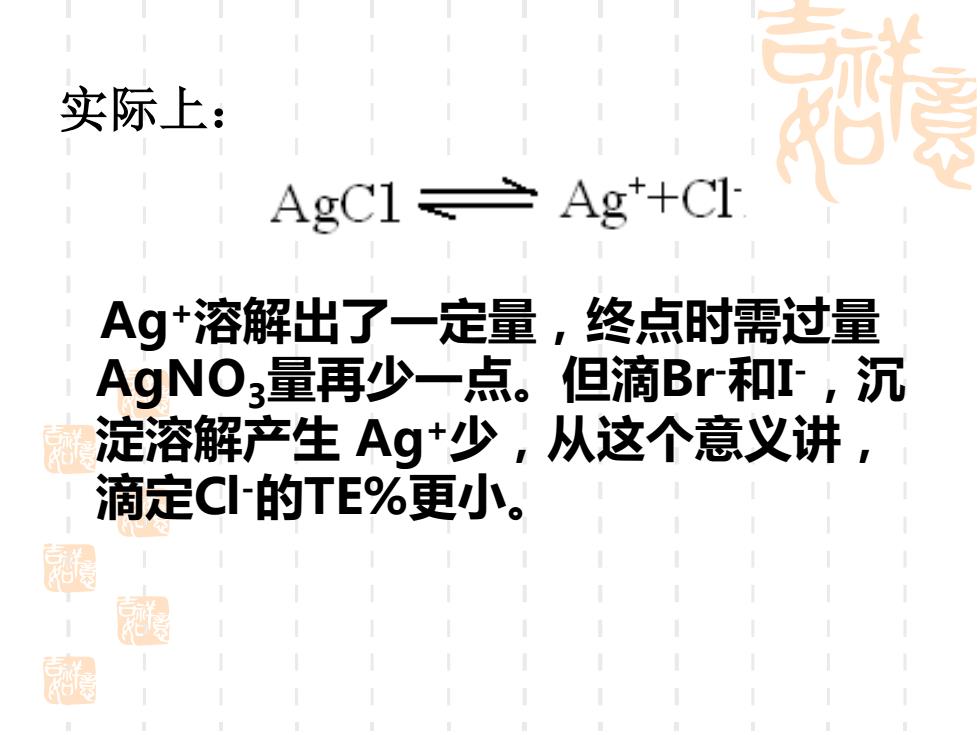
实际上: AgC1≥Ag+C1 Ag+溶解出了一定量,终点时需过量 AgNO量再少一点。但滴Br和I,沉 高淀溶解产生Ag+少,从这个意义讲 滴定C的TE%更小。 思
实际上: Ag+溶解出了一定量,终点时需过量 AgNO3量再少一点。但滴Br-和I -,沉 淀溶解产生 Ag+少,从这个意义讲, 滴定Cl-的TE%更小

3.滴定条件 ① K,CO加入量合适,滴定体积应合适 太大,误差大,必要时做空白校正。 酸度:中性或弱碱性 酸性:CrO4+H→H,CrO4 正误差 碱性: Ag20 制
3.滴定条件 Ag O2 ② 酸度:中性或弱碱性 酸性: 碱性: ① K2CrO4加入量合适,滴定体积应合适, 太大,误差大,必要时做空白校正

③不含NH3,沉淀溶解。 ④干扰离子消除 与Ag+能生成沉淀的阴离子: P043,C032-,As043-等。 与Cr042-生成沉淀的阳离子: Ba+,Pb2+等 型
与Ag+能生成沉淀的阴离子: PO4 3-,CO3 2-,AsO4 3-等。 与CrO4 2-生成沉淀的阳离子: Ba+ ,Pb2+等 ③不含NH3,沉淀溶解。 ④干扰离子消除
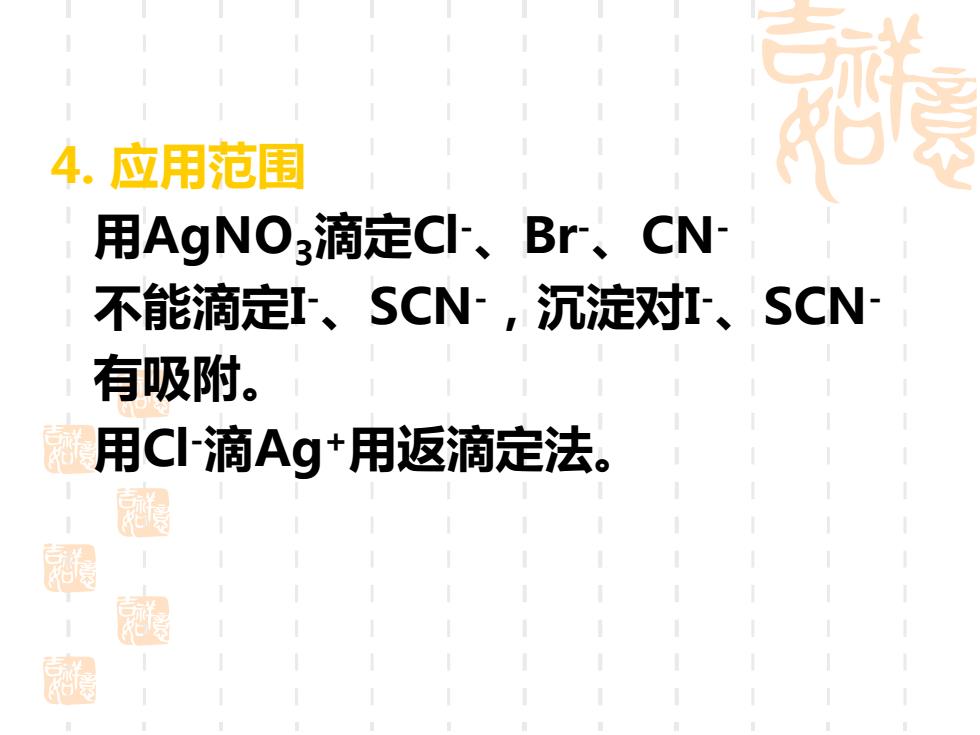
4.应用范围 用AgNO3滴定C、Br、CN- 不能滴定I、SCN,沉淀对I、SCN 有吸附。 用C滴Ag+用返滴定法。 周 超
4. 应用范围 用AgNO3滴定Cl-、Br-、CN- 不能滴定I -、SCN-,沉淀对I -、SCN- 有吸附。 用Cl-滴Ag+用返滴定法