
酸碱反应实际上是两个共轭酸碱对之间的质 子的传递反应,其通式为: 酸+碱2一酸2+碱 其中酸,与碱,为共轭酸碱对;酸,与碱,为共轭 酸碱对
酸碱反应实际上是两个共轭酸碱对之间的质 子的传递反应,其通式为: ⚫ 其中酸1与碱1为共轭酸碱对;酸2与碱2为共轭 酸碱对。 酸1 +碱2 酸2 +碱1
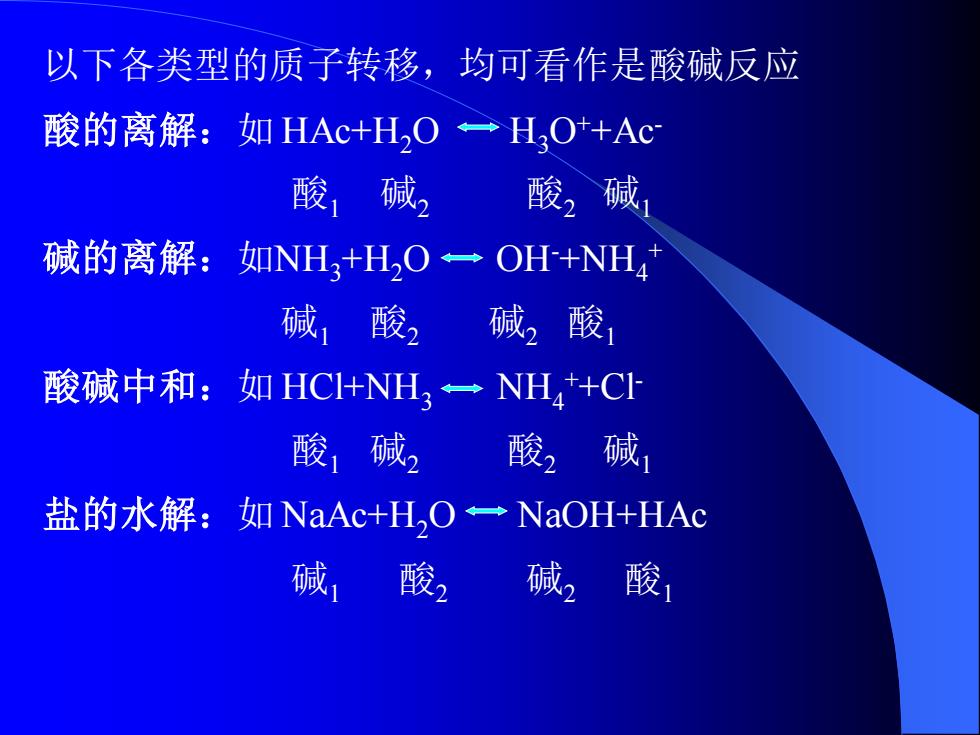
以下各类型的质子转移,均可看作是酸碱反应 酸的离解:如HAc+H,O一H,O+AC 酸1碱2酸2碱 碱的离解:如NH+HO一OH+NH4 碱1酸2 碱2酸1 酸碱中和:如HC+NH3一NH+CI 酸碱2酸2碱 盐的水解:如NaAc+H,O一NaOH+HAc 碱,酸2碱2酸
以下各类型的质子转移,均可看作是酸碱反应 酸的离解:如 HAc+H2O H3O++Ac- 酸1 碱2 酸2 碱1 碱的离解:如NH3+H2O OH-+NH4 + 碱1 酸2 碱2 酸1 酸碱中和:如 HCl+NH3 NH4 ++Cl- 酸1 碱2 酸2 碱1 盐的水解:如 NaAc+H2O NaOH+HAc 碱1 酸2 碱2 酸1
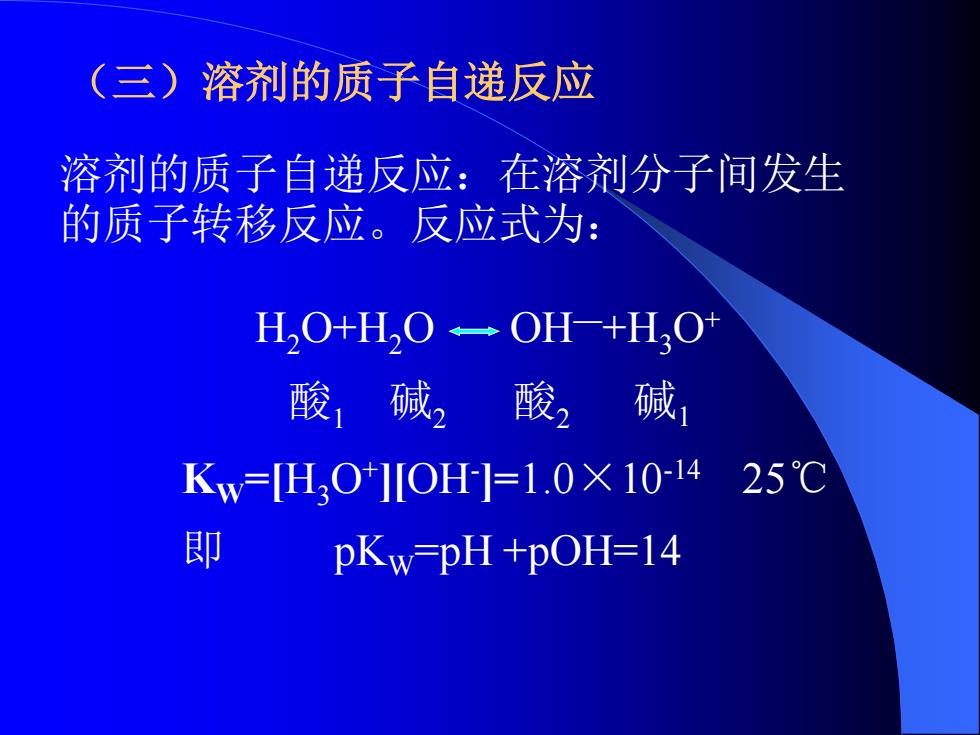
(三)溶剂的质子自递反应 溶剂的质子自递反应:在溶剂分子间发生 的质子转移反应。反应式为: HO+HO一OH-+H,O 酸碱2酸2碱 Kw=HO*]IOH]=1.0×101425℃ 即 pKw-pH +pOH=14
(三)溶剂的质子自递反应 溶剂的质子自递反应:在溶剂分子间发生 的质子转移反应。反应式为: H2O+H2O OH—+H3O+ 酸1 碱2 酸2 碱1 KW=[H3O+ ][OH- ]=1.0×10-14 25℃ 即 pKW=pH +pOH=14

(四)酸碱的强度 在水溶液中酸、碱的强度用其平衡常数K?、Kb 来衡量。K(K)值越大,酸(碱)越强。 HAc+H2O-HO++Ac K=1.75X10-5 NH4+H2O=H,O*+NH3K=5.5×10-10 HC1+H20一H0++C1K3-1.55×10% 三中酸的强度顺序是:HCI>HAc>NH
(四)酸碱的强度 在水溶液中酸、碱的强度用其平衡常数Ka 、Kb 来衡量。 Ka ( Kb )值越大,酸(碱)越强。 HAc+H2O H3O++Ac- Ka=1.75×10-5 NH4 + +H2O H3O+ +NH3 Ka=5.5×10-10 HCl + H2O H3O+ +Cl- Ka=1.55×106 三中酸的强度顺序是:HCl >HAc> NH4 +
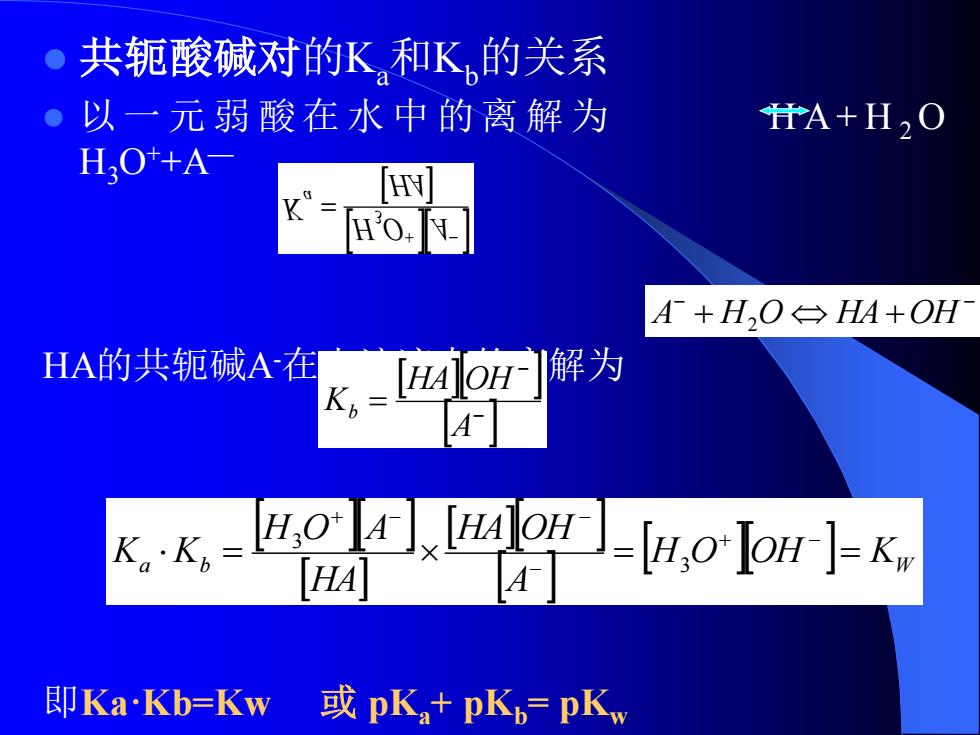
共轭酸碱对的K和K的关系 。以一元弱酸在水中的离解为 HA+H2O HO+A HY A+H,O→HA+OH HA的共轭碱A在 x-[AoH解为 A .-Ho-o Jon-K HA A 即KaKb=Kw 或pK+pKb=pKw
⚫ 共轭酸碱对的Ka和Kb的关系 ⚫ 以一 元 弱 酸在 水 中 的离 解 为 H A + H 2 O H3O++A— HA的共轭碱A-在水溶液中的离解为 即Ka·Kb=Kw 或 pKa+ pKb= pKw HA H O A Ka + − = 3 − − A + H2 O HA+OH − − = A HA OH Kb a b H O OH KW A HA OH HA H O A K K = = = + − − + − − 3 3